
| A. | 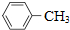 的一溴代物和 的一溴代物和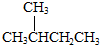 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物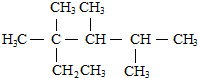 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | 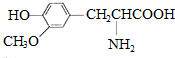 与 与 都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 |
分析 A.有几种氢原子其一溴代物就有几种;
B.该分子结构和乙烯相似,乙烯中所有原子共平面,据此判断该分子结构;
C.该分子中最长的碳链上有6个C原子;
D.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物.
解答 解:A.有几种氢原子其一溴代物就有几种,甲苯、2-甲基丁烷的一溴代物都有4种,故A正确;
B.该分子结构和乙烯相似,乙烯中所有原子共平面,据此判断该分子结构中四个C原子在同一平面上不在同一直线上,故B错误;
C.该分子中最长的碳链上有6个C原子,其名称为2,3,4,4-四甲基己烷,故C错误;
D.结构相似、在分子组成上相差一个或n个-CH2原子团的有机物互称同系物,二者结构不相似,所以不是同系物,故D错误;
故选A.
点评 本题考查同分异构体种类判断、基本概念、有机物命名等知识点,侧重考查学生分析判断及知识迁移能力,明确基本概念内涵、常见物质结构、有机物命名原则是解本题关键,易错选项是C,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 | |
| C. | 原电池中发生的反应达平衡时,该电池仍有电流产生 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该醇至少含有两个碳原子 | B. | 该醇分子中一定没有甲基 | ||
| C. | 该醇分子中一定含有甲基 | D. | 该醇分子中含有一个醇羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com