
在2L密闭容器中发生反应N2+3H2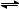 2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol/(L·s),则这段时间为 ( )
2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol/(L·s),则这段时间为 ( )
A. 6 s B. 4 s C. 3 s D. 2 s
科目:高中化学 来源: 题型:
右下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.Y的氢化物的沸点比H2O的沸点高
D.Y元素的非金属性比W元素的非金属性强
| |||
| X | |||
| W | Y | R | |
| Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g)=2C(g)+D(g), 在四种不同情况下的反应速率分别为
①v(A) =0.15mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.5mol/(L·s) ④v (D) =0.45mol/(L·s)
则反应进行由快到慢的顺序为
A.④>③>①>② B.②>④>③>① C.②>③>④>① D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
将甲、乙两种金属的性质相比较,下列不能说明甲的金属性比乙强的是 ( )
A. 甲与水反应比乙与水反应剧烈
B. 甲单质能从乙的盐溶液中置换出单质乙
C. 与某非金属反应时甲原子失电子数目比乙的多
D. 甲的最高价氧化物的水化物比乙的最高价氧化物的水化物碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃组成的混合气体0.1 mol,完全燃烧得0.15 mol CO2和3.6 g H2O,下列关于该混 合气体的说法正确的是( )
A.一定有乙烯 B.一定没有乙烯
C.一定有甲烷 D.可能有乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已二酸是一种重要的化工中间体,可通过氧化环已醇得到。
反应原理为:
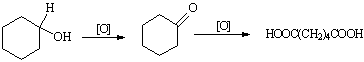
实验步骤:
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后,在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。


(1)写出实验仪器名称:a ▲ ; b ▲ 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: ▲ 。
(3)步骤3趁热抽滤的目的是: ▲ ;如何证明步骤3滤渣已洗涤干净: ▲ 。
(4)步骤4用盐酸酸化的目的是: ▲ 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于铅蓄电池Pb+PbO2+2H2SO4 
 2PbSO4+2H2O的说法正确的是( )
2PbSO4+2H2O的说法正确的是( )
A.放电时,正极发生的反应是 Pb +SO42—+2e— = PbSO4
B.放电时,该电池的负极材料是铅板
C.放电时,电池中硫酸的浓度不断变大
D.放电时,每当消耗1mol铅时转移电子4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com