
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������д���пհף�
(1)�ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע��________��ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����________Ϊֹ��
(2)���в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵�����____����
A ��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B �ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C ��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D ��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
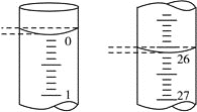
(3)���ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ________mL���յ����Ϊ________mL������������Һ�����Ϊ________mL��
(4)ijѧ������3��ʵ��ֱ��¼�й����������
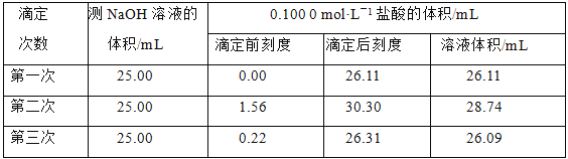
�����ϱ�������ʽ�����NaOH��Һ�����ʵ���Ũ��_______________��
���𰸡���ƿ����ɫ�仯 ������ڲ���ɫ D 0.00 26.10 26.10 0.1044 mol��L��1
��������
(1)�����к͵ζ��ļ��㹫ʽ��c(HCl)V(HCl)=c(NaOH)V(NaOH)���ñ�������ζ������NaOH��Һʱ���ζ�ǰ�豣֤c(HCl)��c(NaOH)��V(NaOH)��ȷ���ζ�ʱ��Ҫȷ��V(HCl)��ȷ�����Եζ��յ��ȷ���ܹؼ����ɴ˿�֪���۾���ע�����ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����ά��һ��ʱ��Ϊֹ��
(2)A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ��Ȼ�������Ũ�ȼ�С���������ƫ��
B.�ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и����������n(NaOH)�ı仯��
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ����Ȼ��ɶ�ȡ��V(HCl)ƫ��
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ�������Ȼ��ɶ�ȡ��V(HCl)ƫС��
(3)���ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������ʱ��Ӧ����С�������λ��
(4)���еڶ���ʵ�飬V(HCl)���������������ƫ��̫��Ӧ����һ��������ʵ������ȡƽ��ֵ�����빫ʽc(HCl)V(HCl)=c(NaOH)V(NaOH)���м��㡣
(1)�ñ�������ζ������NaOH��Һʱ���ζ�ǰ�豣֤c(HCl)��c(NaOH)��V(NaOH)��ȷ���ζ�ʱ��Ҫȷ��V(HCl)��ȷ�����Եζ��������۾�ע����ƿ����ɫ�仯��ֱ�������һ���������Һ�ɻ�ɫ��Ϊ��ɫ����ά�ְ�����ڲ���ɫΪֹ����Ϊ����ƿ����ɫ�仯��������ڲ���ɫ��
(2)���ù�ʽc(NaOH)=![]() ���з�����
�������
A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע������ᣬ��Ȼ�������Ũ�ȼ�С���������ƫ��c(NaOH)ƫ�ߣ�
B.�ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и����������n(NaOH)�ı仯�� V(HCl)���䣬c(NaOH)���䣻
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ����Ȼ��ɶ�ȡ��V(HCl)ƫ��c(NaOH)ƫ�ߣ�
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ�������Ȼ��ɶ�ȡ��V(HCl)ƫС��c(NaOH)ƫ�͡���Ϊ��D��
(3)���ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ������ʼ����Ϊ0.00mL���յ����Ϊ26.10mL������������Һ�����Ϊ26.10mL����Ϊ��0.00��26.10��26.10��
(4)V(HCl)=![]() =26.10mL�� c(NaOH)=
=26.10mL�� c(NaOH)=![]() =
=![]() = 0.1044 mol��L��1������0.1044 mol��L��1��
= 0.1044 mol��L��1������0.1044 mol��L��1��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ô�����CaCO3��100mLϡ���ᷴӦ��ȡCO2��ʵ����̼�¼��ͼ��ʾ(CO2�����������Ϊ��״���µ����)�����з�����ȷ���ǣ� ��
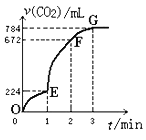
A.F���ռ�����CO2�������
B.OE�α�ʾ��ƽ���������
C.EF���������ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.4mol��L-1min-1
D.OE��EF��FG�����У��÷�Ӧ�ö�����̼��ʾ��ƽ����Ӧ����֮��Ϊ2��6��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������A��B��C��D������ͼת����ϵ(����������ͷ�Ӧ������ȥ)�����������з���ת����ϵ��A�ĸ���ΪA![]() B
B![]() C����Cl2 ��S ��Fe ��NH3 ��AlCl3 ��Na2CO3
C����Cl2 ��S ��Fe ��NH3 ��AlCl3 ��Na2CO3
A.3B.4C.5D.6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷ������ʵĽ����У�����ȷ����

A. ˮ���ȶ�(1000 �����ϲŻᲿ�ַֽ�)����Ϊˮ�к��д������������
B. ����(![]() )�����к���һ������̼ԭ��
)�����к���һ������̼ԭ��
C. �����������Ȼ�̼������������ˮ������������������ԭ������
D. ����ͼ֪���ԣ�H3PO4>HClO����ΪH3PO4�з��ǻ���ԭ�������ڴ������з��ǻ���ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
�����ܵ���ʴﵽ�����ܽ�ƽ��ʱ����Һ�и������ӵ��ܽ�(�����)���ʶ����
�����ܵ���ʴﵽ�����ܽ�ƽ��ʱ���������ܵ���ʵ�����ƽ�����ܽⷽ���ƶ�
����Na2SO4��Һ�м��������BaCl2��Һ����![]() ������ȫ����Һ��ֻ��Ba2����Na����Cl��������
������ȫ����Һ��ֻ��Ba2����Na����Cl��������![]()
��KspС���������ܽ�����һ����Ksp������ʵ��ܽ�����С
��Ϊ����ϴ�ӹ����й������ģ����ѡ��ϡH2SO4����H2O��ϴ��BaSO4����
��ϴ�ӳ���ʱ��ϴ�Ӵ���Խ��Խ��
A.�٢ڢ�B.�٢ڢۢܢݢ�C.��D.�٢ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ũ�ȵ�NaOH��Na2CO3�Ļ����Һ�м���ϡ���ᣮ�������ӷ���ʽ��������ʵ�������
A.OH��+2CO32��+3H+��2HCO3��+H2O
B.2OH��+CO32��+3H+��HCO3��+2H2O
C.2OH��+CO32��+4H+��CO2��+3H2O
D.OH��+CO32��+3H+��CO2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��Ϊԭ�ϣ��ϳ�ijЩ�߾����·����ͼ��
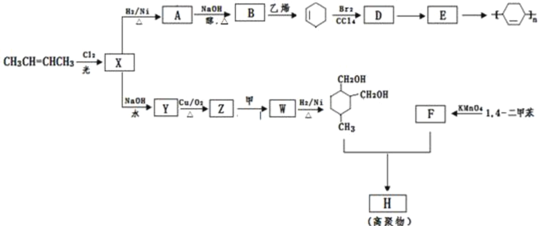
��֪������![]() ����д��
����д��![]() R����ȡ�������⣩
R����ȡ�������⣩
��������
����F����NaHCO3��Ӧ����CO2������������⣺
��1��CH3CH=CHCH3��������______��Br2��CCl4��Һ��______ɫ��
��2��X��Y�ķ�Ӧ����Ϊ��______��D��E�ķ�Ӧ����Ϊ��______��
��3��H�Ľṹ��ʽ��______��
��4��д�����л�ѧ����ʽ��
A��B______��
Z��W______��
��5���������������߾���H�IJ��ʲ������Ԥ�ڣ����ʲ��ߵ�ԭ�������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ2NO��g����O2��g��![]() 2NO2��g����ϵ�У�n��NO����ʱ��仯���±���
2NO2��g����ϵ�У�n��NO����ʱ��仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_____����֪��K��300������K��350��������÷�Ӧ����Ӧ��_________�ȷ�Ӧ�������¶ȣ�����Ӧ����_______������������������С����������������
��2����ͼ�б�ʾNO2�ı仯��������____����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��O2����______��
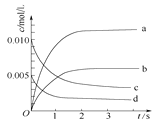
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����__________��
A��v��NO2����2v��O2�� B��������ѹǿ���ֲ���
C��v����NO����2v����O2�� D���������ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_________��
A����ʱ�����NO2���� B���ʵ������¶� C������O2��Ũ�� D��ѡ���Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ķ�����̼�Ͱ�����Ӧ�����ɰ�������粒��壬��ѧ����ʽΪ��2NH3(g)+CO2(g)=NH2COONH4(s) ��H<0�������Ȼ�̼��ͨ�������̼�Ͱ��Ʊ���������淋�ʵ��װ������ͼ��ʾ���ش��������⣺

(1)װ��1�����Ʊ�������̼���壺����״ʯ��ʯ�������Թ��еĴ������ϰ��ϣ�©���������Լ�Ϊ____________��װ��2�������Լ�Ϊ__________________��
(2)װ��4���Լ�Ϊ����NH4Cl��Ca(OH)2��������Ӧ�Ļ�ѧ����ʽΪ___________���Թܿڲ���������б��ԭ����________��װ��3���Լ�ΪKOH��������Ϊ___________��
(3)��Ӧʱ��������ƿ������ˮԡ��ȴ����Ŀ����___________________��
(4)����ʵ����ʵ��˵��N�ķǽ����Ա�C�ķǽ�����ǿ����______________
A. ����:HNO3��H2CO3
B. NH3�ķе����CH4
C. NH3��ˮ�е��ܽ��Դ���CH4��ˮ�е�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com