

分析 由流程可知,加热混有硫酸钠、碳酸氢铵的氯化钠后碳酸氢铵分解,残留物为氯化钠和硫酸钠的混合物,将残留物溶解后加入过量硫酸钡溶液,硫酸根离子与钡离子反应生成硫酸钡沉淀,加入碳酸钠溶液除去过量的钡离子,过滤除去硫酸钡、碳酸钡沉淀后向滤液中加入盐酸除去过量的碳酸钠,最后通过加热煮沸得到纯净的氯化钠,以此来解答.
解答 解:由流程可知,加热混有硫酸钠、碳酸氢铵的氯化钠后碳酸氢铵分解,残留物为氯化钠和硫酸钠的混合物,将残留物溶解后加入过量硫酸钡溶液,硫酸根离子与钡离子反应生成硫酸钡沉淀,加入碳酸钠溶液除去过量的钡离子,过滤除去硫酸钡、碳酸钡沉淀后向滤液中加入盐酸除去过量的碳酸钠,最后通过加热煮沸得到纯净的氯化钠,
(1)操作①是将固体混合物加热,使用到的仪器为坩埚,故答案为:坩埚;
(2)操作②中钡离子与硫酸根离子反应生成硫酸钡沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,检验SO42-已除尽的方法是:静置,取上层清液中滴加BaCl2溶液,若无沉淀说明SO42- 已除尽,
故答案为:静置,取上层清液中滴加BaCl2溶液,若无沉淀说明SO42- 已除尽;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,从而除去过量的氯化钡;不先过滤后加碳酸钠溶液的目的是减少一次过滤操作,
故答案为:除去过量的Ba2+;减少一次过滤操作;故答案为:否;用硝酸钡会引入新杂质NO3-,在以后的操作中无法除去;
(4)操作④的目的是除去溶解在溶液中的HCl 和 CO2,故答案为:除去溶解在溶液中的HCl 和 CO2;
(5)改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,以后操作中无法除去,则不能改用硝酸钡,
故答案为:否;改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,以后操作中无法除去.
点评 本题考查混合物分离提纯,为高频考点,把握流程中发生的反应、混合物分离为解答关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐.实验室以盐泥为原料制取MgSO4•7H2O的流程如下:[29g盐泥]$→_{②H_{2}SO_{4}调pH=1-2}^{①水,调成泥浆}$$→_{④过滤}^{③煮沸}$[滤液Ⅰ]$→_{⑥煮沸,趁热}^{⑤加NaClO,pH=5~6}$[滤液Ⅱ]→产品
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐.实验室以盐泥为原料制取MgSO4•7H2O的流程如下:[29g盐泥]$→_{②H_{2}SO_{4}调pH=1-2}^{①水,调成泥浆}$$→_{④过滤}^{③煮沸}$[滤液Ⅰ]$→_{⑥煮沸,趁热}^{⑤加NaClO,pH=5~6}$[滤液Ⅱ]→产品查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是( )| A. | Cu极为原电池负极 | |
| B. | Cu极附近OH-浓度增大 | |
| C. | 电子流向是由C极流向Pt极 | |
| D. | 当C极上有4 mol电子转移时,Pt极上有1 mol O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氢气所占体积约为22.4 L | |
| B. | 气态物质所占的体积主要由分子数目和分子间距离决定的 | |
| C. | 1 mol O2与1 mol O3所含的分子数目相等 | |
| D. | 物质的聚集状态不同主要是构成物质的基本粒子间的距离不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羊毛与涤纶-灼烧 | B. | 铝片与银片-加稀硫酸 | ||
| C. | 硬水与软水-过滤 | D. | 食盐水与食醋-闻气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸可除水垢 | |
| B. | 甘油可做护肤保湿剂 | |
| C. | 包装用的聚氯乙烯属于烃 | |
| D. | 酯类物质是形成水果香味的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
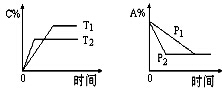 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | ||
| C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com