
【题目】下列各组物质:(用序号填空)
① O2和O3 ; ②12C 与14C; ③ CH3 (CH2) 3 CH3和![]()
④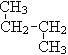 和
和![]() ;
;
(1)互为同位素的是_______ ;(2)互为同素异形体的是________;
(3)互为同分异构体的是________;(4)属于同一物质的是________。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】在图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
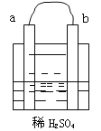
A. 碳棒上有气体放出,溶液的pH增大
B. 导线中有电子流动,电子从a极流到b极
C. a是正极,b是负极
D. a极上发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
选项 | X | Y | Z |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | SiO2 | Na2SiO3 | H2SiO3 |
C | CO2 | Na2CO3 | NaHCO3 |
D | NH3 | NO2 | HNO3 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八种短周期元素x、y、z、d、e、f、g、h原子序数依次递增,其原子半径、最高正价或最低负价如下表所示。
x | y | z | d | e | f | g | h | |
原子半径/nm | 0.037 | 0.077 | 0.075 | 0.074 | 0.186 | 0.143 | 0.102 | 0.099 |
最高正化合价或最低负化合价 | +1 | +4 | +5 | -2 | +1 | +3 | -2 | -1 |
回答下列问题:
(1)比较d、f常见离子的半径大小(用化学式表示,下同):_______>________;比较g、h的最高价氧化物对应水化物的酸性强弱:________>__________。
(2)由x、d两种元素组成18电子的分子,其电子式为____________,经测定其为二元弱酸,其酸性比碳酸弱,写出其第一步电离的电离方程式____________。
(3)y、d、e组成物质e2yd3的水溶液呈碱性,其原因是____________________(用离子方程式表示),电解该物质e2yd3的溶液,原理如图所示。

其中,离子交换膜使用的是__________(填“阳离子交换膜”或“阴离子交换膜”),阴极产生的物质A的化学式为____________。
(4)f的粉末在1000℃时可与N2反应制备fN。在f的粉末中添加少量NH4Cl固体并充分混合,有利于fN的制备,其主要原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸钾是一种白色粉末,可用作发烟剂、引火剂、氧化剂和化学分析试剂,医药工业用作解热和利尿等药剂。用PbO2来制备KClO4的工业流程如下:

(1)如图过滤装置中有两处明显错误,一处是未用玻璃棒引流,另一处是__。
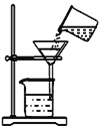
(2)写出NaClO3与PbO2反应的离子方程式_______________
(3)工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是______________
(4)用电解法也可以制备KClO4,在无隔膜、微酸性条件下,电解食盐水得到NaClO3溶液,再通过一系列转化和操作得到产品。
I.写出电解食盐水阳极电极反应式:______________________________
II.该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取5.7635 g样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-,反应为:
3KClO4+C6H12O6=6H2O+6CO2↑+3KCl,加入少量K2CrO4溶液作指示剂,用0.20mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积21.50 mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
①已知:Ksp(AgCl)=1.8×l0-10,Ksp(Ag2CrO4)=1.1×10-12,若终点时c(Cl-)=1.8×10-6 mol·L-1,则此时c(CrO42-)=______________mol·L-1。
②KClO4样品的纯度为______________。(精确到0.01%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 2.8 g环已烷含共价键数目为0.4NA
B. 过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.4NA
C. 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D. 用惰性电极电解CuSO4溶液后,如果加入0.1 molCu(OH)2能使溶液复原,则电路中转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使甲基橙变黄色的溶液中:Na+、Al3+、SO42、Cl
B. pH=7的溶液中:K+、Na+、AlO2、CO32
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3、SO42
D. ![]() =1×1013 molL1的溶液中:NH4+、Ca2+、Cl、NO3
=1×1013 molL1的溶液中:NH4+、Ca2+、Cl、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化可得到有机物(CH3)2C=C(CH3)2(以下用A表示)。
(1)A的系统命名为________;A在通常状况下呈________(填“气”“液”或“固”)态。
(2)A与Br2的加成产物B与NaOH的乙醇溶液共热可生成二烯烃C,则C的结构简式为___________________;B生成C的反应类型为________。
(3)C与一定量Br2反应可能生成D、E和G,而D与HBr的加成产物只有F,则D形成高分子化合物的化学方程式为__________________________________________。
(4)C的同分异构体中不可能为________(填字母)
a.芳香烃 b.炔烃 c.环烯烃 d.二烯烃
若C的一种同分异构体H与KMnO4酸性溶液生成己二酸,则H的结构简式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是

A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法
B. 若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法
D. 若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com