
��6�֣�ˮ��Һ�д��ڶ���ƽ�⣬�������ѧ��ѧ֪ʶ�ش��������⣺
��1����Ũ�Ⱦ�Ϊ0.1mol/L��CH3COONH4 ��NH4HSO4 ��NH3.H2O ��(NH4)2SO4��Һ�У�NH4+Ũ���ɴ�С��˳��Ϊ ������ţ�
��2��Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ��������Һ����ˮ�������H��Ũ���ɴ�С��˳����(�����) ��
��3�������£���pH=6������ˮ�м���2.3g�����ƣ���ַ�Ӧ���ټ�����ˮϡ�͵�1L��������Һ��pH= ��
��1����>��>��>�ۣ���2����>��>��>�٣���3��11
��������
������������������ʵ���Һ�д��ڵĴ�������ʽ�ǣ���CH3COONH4= CH3COO-+NH4+����NH4HSO4=NH4++H++SO42-����NH3.H2O NH4++OH-����(NH4)2SO4= 2NH4++ SO42-���ڢ٢ڢ��ж�����NH4+����ˮ�ⷴӦ�Ķ�����ʹ���ӵ�Ũ�ȼ�С����CH3COO-��ǰ����ٽ����ã�ʹ����Ũ�Ƚ�һ����С����H+��NH4+����ˮ�ⷴӦ���������ã����Ԣ�>��.���������غ��֪��>�ڣ�NH3.H2O��������ʣ�����̶������ģ�����������Ũ��ԶС���ε������������Ũ�ȣ���ˢ�>�ۡ���������Һ�е�����Ũ�ȹ�ϵ���Ǣ�>��>��>�ۣ���2���������Ƕ�Ԫǿ�ᣬ��ȫ���룻������������һԪǿ���ȫ����ڴ�����һԪ���ᣬ���ֵ��룬���Dz��������Ӷ�ˮ�ĵ������������ã��������������Ũ��Խ��ˮ�ĵ�����������þ�Խ�����Զ�ˮ���������â�>��>�ڣ����Ȼ����ǿ�������Σ����������NH4+����ˮ�ⷴӦ����ˮ���������OH-����ٽ�ˮ�ĵ������á�������ˮ�������H��Ũ���ɴ�С��˳���Ǣ�>��>��>�٣���3�������£���pH=6������ˮ�м���2.3g�����ƣ�n(OH-)=0.1mol��c(OH-)=0.1mol/L,������������Һ��pH=6�������ڸ��¶��µ�ˮ�����ӻ���������1��10-12��c(H+)=1��10-12��0.1mol/L=1��10-11,���Գ�ַ�Ӧ���ټ�����ˮϡ�͵�1L��������Һ��pH=11.
NH4++OH-����(NH4)2SO4= 2NH4++ SO42-���ڢ٢ڢ��ж�����NH4+����ˮ�ⷴӦ�Ķ�����ʹ���ӵ�Ũ�ȼ�С����CH3COO-��ǰ����ٽ����ã�ʹ����Ũ�Ƚ�һ����С����H+��NH4+����ˮ�ⷴӦ���������ã����Ԣ�>��.���������غ��֪��>�ڣ�NH3.H2O��������ʣ�����̶������ģ�����������Ũ��ԶС���ε������������Ũ�ȣ���ˢ�>�ۡ���������Һ�е�����Ũ�ȹ�ϵ���Ǣ�>��>��>�ۣ���2���������Ƕ�Ԫǿ�ᣬ��ȫ���룻������������һԪǿ���ȫ����ڴ�����һԪ���ᣬ���ֵ��룬���Dz��������Ӷ�ˮ�ĵ������������ã��������������Ũ��Խ��ˮ�ĵ�����������þ�Խ�����Զ�ˮ���������â�>��>�ڣ����Ȼ����ǿ�������Σ����������NH4+����ˮ�ⷴӦ����ˮ���������OH-����ٽ�ˮ�ĵ������á�������ˮ�������H��Ũ���ɴ�С��˳���Ǣ�>��>��>�٣���3�������£���pH=6������ˮ�м���2.3g�����ƣ�n(OH-)=0.1mol��c(OH-)=0.1mol/L,������������Һ��pH=6�������ڸ��¶��µ�ˮ�����ӻ���������1��10-12��c(H+)=1��10-12��0.1mol/L=1��10-11,���Գ�ַ�Ӧ���ټ�����ˮϡ�͵�1L��������Һ��pH=11.
���㣺�����ε�ˮ�⡢Ӱ��ˮ�ĵ���ĸ������أ�ˮ�����ӻ���������Һ��pH�ļ����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014��2015��ӱ�ʡ��һ��һѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ײ��ϡ�������ֱ��Ϊ1nm��100nm�IJ��ϣ�����̼��������һ�֡�ij�о���������̼���ȷ�ɢ������ˮ�У��õ������ʣ�������Һ ���ǽ��� �۾��ж�������� �ܲ�������Ĥ �ݲ�������ֽ��ֹ�����ֺ�ɫ������������ȷ���ǣ� ��
A���٢ܢ� B���ڢۢ� C���ڢۢ� D���٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�������ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���н��������Ĵ�ʩ�У�ʹ����ӵ�������������������
A��ˮ�еĸ�բ�����ӵ�Դ�ĸ��� B��������������Ϳ��
C������������Ϳ�߷���Ĥ D�����¸ֹ�����þ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�B�㻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʽΪC5H12O�ҿ�������Ʒ�Ӧ�ų��������л��������У������������칹���� ��
A��5�� B��6�� C��7�� D��8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�A�㻯ѧ�Ծ��������棩 ���ͣ������
��10�֣��ݡ��������������������궬�죬һ�����ִ���������Ⱦ���������������п��ܽ����������ء�����ҵ��λ����ʵ�����ʵ��Ա���ݼٻ��Թ����ơ��������е�CO���������SO2���̳�����Ⱦ�ǵ�������������ԭ��֮һ����ѧ��Ӧԭ���Ǽ��ٺͿ��������������������ݡ�
��1��CO2�������������������գ�����0.4molCO2������200ml 3mol/LNaOH��Һ������ȫ���գ���Һ������Ũ���ɴ�С��˳��Ϊ��
��2�� CO������ȼ�ϵ�أ���KOH��Һ������ʣ��������ֱ����CO�Ϳ��������������У�������Ӧ����ʽΪ��___________________��
��3�� ����Fe2+��Fe3+�Ĵ����ã������½�SO2ת��ΪSO42�����Ӷ�ʵ�ֶ�SO2�Ĵ���(�ܷ�ӦΪ2SO2+O2+2H2O��2H2SO4)����֪����SO2�ķ���ͨ�뺬Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ4Fe2+ + O2+ 4H+ ��4Fe3+ + 2H2O������һ��Ӧ�����ӷ���ʽΪ ��
��4��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
��5����֪�ڳ��³�ѹ�£�
��CH3OH(l)+O2(g)= CO(g)+2H2O(g) ��H= -359.8 kJ��mol��1
�� 2CO(g)��O2(g)=2CO2(g) ?��H= -556.0 kJ��mol��1
�� H2O(g)=H2O(l)? ��H= -44.0 kJ��mol��1
д�����ּ״�ȼ���ȵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�A�㻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���淴Ӧ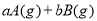
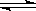
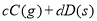
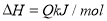 ����Ӧ�����У���������������ʱ��C�ڻ�����еĺ������¶ȣ�T���Ĺ�ϵ��ͼI��ʾ����Ӧ���ʣ�v����ѹǿ��p���Ĺ�ϵ��ͼII��ʾ����ͼ����������˵����ȷ���ǣ�������
����Ӧ�����У���������������ʱ��C�ڻ�����еĺ������¶ȣ�T���Ĺ�ϵ��ͼI��ʾ����Ӧ���ʣ�v����ѹǿ��p���Ĺ�ϵ��ͼII��ʾ����ͼ����������˵����ȷ���ǣ�������
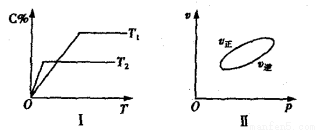
A��T1��T2��Q��0 B������ѹǿ������B��ת��������
C����Ӧ��ƽ�������������D��ƽ�������ƶ��� D��a+b��c+d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У���߶�9���¿�A�㻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��˵��0.1 mol��L��1��NaHA��Һһ�������Ե���(����)
��ϡ��ʱ����Һ��c(OH��)���� ����Һ��pH��7
����Һ��c(Na��)��c(A2��) ����Һ�������������ʵ���Ũ�ȵ�NaOH��Һǡ�÷�Ӧ
A���٢ڢ� B���٢ۢ� C���٢� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��2015ѧ�꽭�����ݸ�����ѧ��У����һ9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ����������������������ȷ����
A����״���£�22.4LH2O���еķ�����Ϊ NA
B��ͨ��״���£�NA ��CO2����ռ�е����Ϊ22.4L
C�����ʵ���Ũ��Ϊ1mol/L��MgCl2��Һ�У�����Cl������Ϊ2NA
D�����³�ѹ�£�1.06g Na2CO3���е�Na+������Ϊ0.02 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�����ʡ�����и߶���ѧ�����л�ѧ���ģ��Ծ��������棩 ���ͣ�ѡ����
��������IJ�������Ϊ�ŷŴ�����Ⱦ�ﵪ�������ص���
A������ B���⻯ѧ����
C������ D��������ն�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com