
【题目】A、B、C、D、E五种物质焰色均为黄色,它们按图所示互相转化.

(1)这五种物质中,A:______、C:______.
(2)将CO2通入E的饱和溶液中,该反应的离子方程式为__________________________.
(3)写出A→D、C→D反应的化学方程式
A→D:______________________________
C→D:______________________________
(4)现将C与NaHCO3固体按物质的量之比为3:2于真空密闭容器中混合加热,则剩余固体成分为_______________。
(5)将a g葡萄糖在足量氧气中完全燃烧,将所得产物全部通入过量C中,固体增重________a g。(填大于,小于,等于)
【答案】Na Na2O2 CO2+H2O+2Na++CO32-=2NaHCO3↓ 2Na+2H2O=2NaOH+H2 2Na2O2+2H2O=4NaOH+O2 Na2CO3 Na2O2 NaOH 等于
【解析】
A、B、C、D、E五种物质焰色均为黄色,五种物质中均含有Na元素;A能在O2中燃烧生成C、在空气中短期接触生成B、与水反应生成D,则A为Na,B为Na2O,C为Na2O2,D为NaOH;B、C、D都能与CO2反应生成E,E为Na2CO3;根据上述推断作答。
A、B、C、D、E五种物质焰色均为黄色,五种物质中均含有Na元素;A能在O2中燃烧生成C、在空气中短期接触生成B、与水反应生成D,则A为Na,B为Na2O,C为Na2O2,D为NaOH;B、C、D都能与CO2反应生成E,E为Na2CO3。
(1)这五种物质中,A为Na,C为Na2O2。
(2)将CO2通入Na2CO3的饱和溶液中反应生成NaHCO3,由于NaHCO3的溶解度小于Na2CO3且反应消耗H2O,所以有白色晶体析出,反应的化学方程式为CO2+Na2CO3+H2O=2NaHCO3↓,反应的离子方程式为CO2+2Na++CO32-+H2O=2NaHCO3↓。
(3)A→D的化学方程式为2Na+2H2O=2NaOH+H2↑。
C→D的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。
(4)将Na2O2与NaHCO3固体按物质的量之比为3:2于真空密闭容器中混合加热,首先发生反应2NaHCO3![]() Na2CO3+H2O+CO2↑,2mol的NaHCO3完全分解生成1molNa2CO3、1molCO2和1molH2O;然后Na2O2先与CO2发生反应2Na2O2+2CO2=2Na2CO3+O2,1molCO2消耗1molNa2O2同时生成1mol Na2CO3;剩余2molNa2O2继续与水发生反应2Na2O2+2H2O=4NaOH+O2↑,1molH2O消耗1molNa2O2同时生成2mol NaOH;仍然剩余1molNa2O2;剩余固体的成分为Na2CO3、NaOH、Na2O2。
Na2CO3+H2O+CO2↑,2mol的NaHCO3完全分解生成1molNa2CO3、1molCO2和1molH2O;然后Na2O2先与CO2发生反应2Na2O2+2CO2=2Na2CO3+O2,1molCO2消耗1molNa2O2同时生成1mol Na2CO3;剩余2molNa2O2继续与水发生反应2Na2O2+2H2O=4NaOH+O2↑,1molH2O消耗1molNa2O2同时生成2mol NaOH;仍然剩余1molNa2O2;剩余固体的成分为Na2CO3、NaOH、Na2O2。
(5)葡萄糖在足量O2中完全燃烧的化学方程式为C6H12O6+6O2![]() 6CO2+6H2O(①),生成的产物全部通入过量Na2O2中,发生反应:2Na2O2+2CO2=2Na2CO3+O2(②),2Na2O2+2H2O=4NaOH+O2↑(③),由于Na2O2过量,CO2、H2O全部反应,将①+②×3+③×3得“C6H12O6+12Na2O2→6Na2CO3+12NaOH”,可见固体增重等于葡萄糖的质量,固体增重等于ag。
6CO2+6H2O(①),生成的产物全部通入过量Na2O2中,发生反应:2Na2O2+2CO2=2Na2CO3+O2(②),2Na2O2+2H2O=4NaOH+O2↑(③),由于Na2O2过量,CO2、H2O全部反应,将①+②×3+③×3得“C6H12O6+12Na2O2→6Na2CO3+12NaOH”,可见固体增重等于葡萄糖的质量,固体增重等于ag。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧可放出3 147.9 kJ的热量 ,则下列热化学方程式正确的是( )
A. C(s)+O2(g)=CO2(g) ΔH=—393.49 kJ/mol
B. C+O2=CO2 ΔH=-393.49 kJ/mol
C. C(s)+O2(g)=CO2(g) ΔH=+393.49 kJ/mol
D. C(s)+![]() O2(g)=CO(g) ΔH=-393.49 kJ/mol
O2(g)=CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是________,只有还原性的是________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是________。
(3)下列三个氧化还原反应中,氧化性最强的物质是________。
①2FeCl3+2KI===2FeCl2+2KCl+I2 ②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的________作氧化剂。
(4)请配平以下化学方程式:___
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取未知浓度的硫酸、盐酸和醋酸各25.00mL,分别用0.10mol/L的NaOH溶液或0.10mol/L的稀氨水滴定得到下图曲线。下列说法正确的是
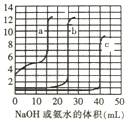
A. 由图可知曲线c为NaOH滴定硫酸
B. 由图可知硫酸的物质的量浓变大于盐酸的物质的量浓度
C. 曲线b、c的滴定实验可用酚酞做指示剂
D. 由图可知滴定前醋酸的物质的量浓度为0.060mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a An+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
A. 原子序数:b>a>c>dB. 最高价氧化物对应水化物的碱性:B>A
C. 四种离子的电子层结构相同,因而离子的性质也相同D. 气态氢化物的稳定性:D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置模拟生成过程。
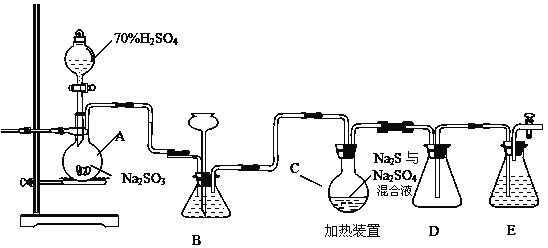
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 __________________________,则整个装置气密性良好。装置D的作用是___________________________。装置E中为___________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为______________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择__________ 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是____________。
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是_______________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有___________________。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是( )
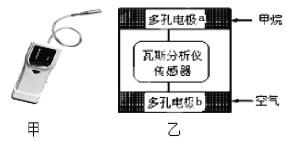
A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
C. 电极b是正极, O2-由电极a流向电极b
D. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com