
【题目】海洋是一个巨大的化学资源宝库。海水综合利用的部分流程如下:

已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。
(1)操作A是___________(填实验基本操作名称),粗盐中常含 Ca2+、Mg2+、SO42-等杂质离子,可依次加入NaOH、______ 、______、盐酸试剂来进行提纯。
(2)操作B需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)已知母液中的主要成分如下表:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
理论上,1m3母液中最多可得到Mg(OH)2的质量为___________。
(4)利用下图所示装置模拟工业上从母液中提取溴,在B瓶中得到较浓的溴水。

实验方案为:关闭b、d,打开a、c,由a向A中缓慢通入________至反应完全,发生反应的的离子方程式是_________________________;再关闭a、c,打开b、d、e,由b向A中鼓入足量_________,同时由 e 向B中通入足量_________;关闭b、e,打开a,再由a 向B中缓缓鼓入足量___________,即可在B中得到较浓的溴水。(本实验中须使用的试剂有:SO2、Cl2、热空气) 。
【答案】 蒸发结晶 BaCl2 Na2CO3 C 6.96×104 g(或69.6 kg) Cl2 Cl2 + 2Brˉ= 2Clˉ + Br2 热空气 SO2 Cl2
【解析】(1)海水通过操作A得到粗盐和母液,操作A应该为蒸发结晶;粗盐中常含 Ca2+、Mg2+、SO42-,Mg2+用OH-离子沉淀,SO42-用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子。故可依次加入NaOH、BaCl2、Na2CO3、盐酸试剂来进行提纯;(2)通过操作B得到氢氧化镁,则结合海水综合利用,应该是将海水中的镁离子沉淀,最适合是选择石灰乳,答案选c;(3)滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品Mg(OH)2,溶液中Mg2+浓度为28.8g/L,
Mg2+~~~~~~~~Mg(OH)2
24g 58g
28.8g/L×1000L m[Mg(OH)2]
m[Mg(OH)2]= ![]() =6.96×104g=69.6kg;
=6.96×104g=69.6kg;
(4)从母液中提取溴,关闭b、d,打开a、c,由a向A中缓慢通入Cl2至反应完全,氯气将溴置换出来,发生反应的的离子方程式是:Cl2 + 2Brˉ= 2Clˉ + Br2;再关闭a、c,打开b、d、e,由b向A中鼓入足量热空气,同时由 e 向B中通入足量SO2;关闭b、e,打开a,再由a 向B中缓缓鼓入足量Cl2,即可在B中得到较浓的溴水。


科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 比较S和Si的非金属性强弱 | 向Na2SiO3溶液中通入SO2产生白色沉淀 |
B | 除去NaHCO3溶液中的杂质Na2CO3 | 向混合液中通入足量的CO2气体 |
C | 检验某盐是否为铵盐 | 试样 |
D | 验证H2O2和Fe3+的氧化性 强弱 | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molNa和1molAl的混合物投入足量水中,产生气体在标准状况下的体积为 ( )
A. 11.2L B. 22.4L C. 33.6L D. 44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的曲线: 表示其他条件一定,2NO + O2![]() 2NO2(该反应为放热)反应达到平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点, 其中表示未达到平衡状态,且 v正>v逆 的点是( )
2NO2(该反应为放热)反应达到平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点, 其中表示未达到平衡状态,且 v正>v逆 的点是( )
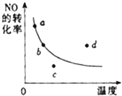
A. a点 B. b点 C. c点 D. d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题:
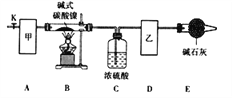
(l)甲、乙两装置可分别选取下列装置______、_______(填字母,装置可重复选取)。

(2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中________________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气,其目的是______________________________。
(3)装置A的作用是________________________________________________,若没有装置E,则会使x/z__________(填写“偏大”或“偏小”或“无影响”)。
(4)实验前后测得下表所示数据:
装置B中样品质量/g | 装置C 质量/g | 装置D质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍分解的化学方程式为_______。
(5)采取上述实验装置进行该实验时,必须小心操作,且保证装置气密性良好,否则浓硫酸倒吸,可导致加热的硬质玻璃管炸裂。为防止浓硫酸倒吸入硬质玻璃管中,提出你的改进措施:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com