
| A.NaOH溶液? | B.蒸馏水? | C.Na2SO3溶液? | D.KI溶液) |
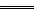 NaCl+NaClO+H2O,2mol NaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电能力不变。由于氯气和亚硫酸钠发生如下反应:Cl2+Na2SO3+H2O
NaCl+NaClO+H2O,2mol NaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电能力不变。由于氯气和亚硫酸钠发生如下反应:Cl2+Na2SO3+H2O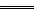 2HCl+Na2SO4,从吸收容量上看,用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电荷总量看),符合导电性增强。选项C为正确答案。
2HCl+Na2SO4,从吸收容量上看,用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电荷总量看),符合导电性增强。选项C为正确答案。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.NaCl-HCl | B.NaHCO3-H2CO3 |
| C.NaOH-HCl | D.Na2CO3-HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaNO2在水溶液中完全电离 |
| B.HNO2能使石蕊试液变红 |
| C.等物质的量浓度的HNO2的导电能力比盐酸弱 |
| D.0.1mol/L的HNO2溶液的PH为2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解质的电离过程就是产生自由移动离子的过程 |
| B.碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质 |
| C.氯气和氨气的水溶液导电性都很好,所以它们是强电解质 |
| D.水难电离,纯水几乎不导电,所以水是弱电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.降低温度,溶液中c(NH4+)增大 | ||
| B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 | ||
| C.加入少量0.1mol?L-1 HCl溶液,溶液中c(OH-)增大 | ||
D.加入水时,溶液中
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com