
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2011-2012学年云南省昆明三中高一下学期期末考试化学试卷(带解析) 题型:填空题
(10分)由铜、锌和稀硫酸组成的原电池中: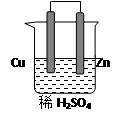
锌是 极,电极反应式是 。
铜是 极,电极反应式是 。
在铜极上可以观察到有 (填实验现象)
查看答案和解析>>
科目:高中化学 来源:2014届云南省高一下学期期末考试化学试卷(解析版) 题型:填空题
(10分)由铜、锌和稀硫酸组成的原电池中:

锌是 极,电极反应式是 。
铜是 极,电极反应式是 。
在铜极上可以观察到有 (填实验现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学用以下装置研究电化学的问题。
(1)甲装置是由铜、锌和稀硫酸组成的原电池,其中正极材料
 是 ,电池的总反应式用离子方程式表示
是 ,电池的总反应式用离子方程式表示
为 。当导线中有1 mol电子
通过时,理论上两极的变化是 (填序号)。
A.锌片溶解了32.5 g B.锌片增重32.5 g
C.铜片上析出l g H2 D.铜片上析1molH2
(2)若乙装置中X、Y都是惰性电极,a是滴有酚酞试液的饱和
 NaCl溶液。电解过程中观察到 (填X或Y)
NaCl溶液。电解过程中观察到 (填X或Y)
极附近溶液变红色,电解反应的总化学方程式
为 。
(3)若要通过乙装置用电解方法精炼粗铜,电解质溶液a选用
CuSO4溶液,则X电极的材料是 ,X极的
电极反应式为 。
(4)若乙装置中X、Y都是惰性电极,a是1mol·L-1CuCl2溶液,
实验开始10min后,CuCl2溶液浓度为0.6 mol·L-1,则反应
开始至10min,CuCl2的反应速率v(CuCl2)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com