

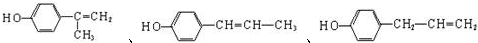 ��
��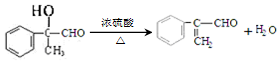 ��
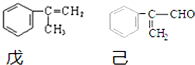
�� ���� ��1��������Է�������86����ϼ�������������ˮ�����ΪCH2=C��CH3��COOH��CH3OH��CH2=C��CH3��COOH�������ԣ���Է�������86�����������ɼ�ת������������ˮ�⣬��Ϊ�Ҷ�����1mol�ܺ�2mol���ᷴӦ�����������кͼ���ͬ�Ĺ����ţ�������̼̼˫�����ܺ��嵥�ʷ����ӳɷ�Ӧ��
��2����Ϊ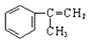 �������ˮ�����ӳɷ�Ӧ����A��A�Ľṹ��ʽΪ��
�������ˮ�����ӳɷ�Ӧ����A��A�Ľṹ��ʽΪ��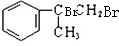 ��
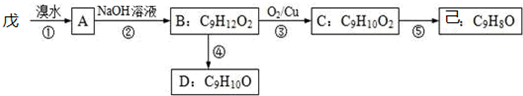
��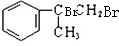 ���������Ƶ�ˮ��Һ����ȡ����Ӧ����B��B�Ľṹ��ʽΪ��
���������Ƶ�ˮ��Һ����ȡ����Ӧ����B��B�Ľṹ��ʽΪ��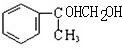 ��B����������C����C�Ľṹ��ʽΪ��
��B����������C����C�Ľṹ��ʽΪ��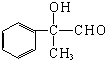 �����Ľṹ��ʽΪ��
�����Ľṹ��ʽΪ�� �����к���̼̼˫����C������ȥ��Ӧ���ɼ�����B��D����ʽ��֪��B��ȥ1����ˮ����D��D�Ľṹ��ʽΪ��
�����к���̼̼˫����C������ȥ��Ӧ���ɼ�����B��D����ʽ��֪��B��ȥ1����ˮ����D��D�Ľṹ��ʽΪ�� ���Դ˽����⣮
���Դ˽����⣮
��� �⣺��1����������������ˮ�⣬CH2=C��CH3��COOCH3$\stackrel{H+}{��}$CH2=C��CH3��COOH+CH3OH��CH2=C��CH3��COOH�������ԣ���Է�������86��Ϊ�����ʣ��ɼ�ת����������������ˮ������ȡ����Ӧ���Ҷ�����CH2=C��CH3��COOH�����ʵ���1��2����������Ӧ����ӦΪHOCH2CH2OH+CH2=C��CH3��COOH$��_{��}^{ŨH_{2}SO_{4}}$CH2=C��CH3��COOCH2CH2OOCC��CH3��=CH2+2H2O����Ӧ�����������кͼ���ͬ�Ĺ����ţ�����ϩ�к�̼̼˫��������ˮ�ɷ����ӳɷ�Ӧ����Ӧ����ʽΪ +Br2��
+Br2�� ����ˮ��ɫ��
����ˮ��ɫ��
�ʴ�Ϊ��ˮ�ⷴӦ��ȡ����Ӧ��2��̼̼˫����
��2����a����Ϊ �������ˮ�����ӳɷ�Ӧ����A��A�Ľṹ��ʽΪ��
�������ˮ�����ӳɷ�Ӧ����A��A�Ľṹ��ʽΪ��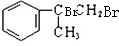 ��
��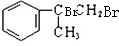 ���������Ƶ�ˮ��Һ����ȡ����Ӧ����B��B�Ľṹ��ʽΪ��
���������Ƶ�ˮ��Һ����ȡ����Ӧ����B��B�Ľṹ��ʽΪ��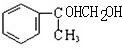 ��B����������C����C�Ľṹ��ʽΪ��
��B����������C����C�Ľṹ��ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��b�� D�Ľṹ��ʽΪ�� ��D��ͬ���칹���������������
��D��ͬ���칹���������������
a�������ϵ�һ�ȴ��������֣�˵�������Ϻ���������ԭ�ӣ�
b����FeCl3��Һ������ɫ��Ӧ��˵�����з��ǻ���
c������Br2/CCl4�����ӳɷ�Ӧ��˵������̼̼�����ͼ���
�����������D��ͬ���칹���У� ��
�� ��
�� ��
��
�ʴ�Ϊ�� ��
�� ��
�� ��
��
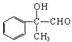
��C��C�Ľṹ��ʽΪ�� �����C��������ʽ��֪��C��ȥ1����ˮ���ɼ���C������ȥ��Ӧ���ɼ����Ľṹ��ʽΪ��
�����C��������ʽ��֪��C��ȥ1����ˮ���ɼ���C������ȥ��Ӧ���ɼ����Ľṹ��ʽΪ�� ��Cת��Ϊ���Ļ�ѧ����ʽΪ��
��Cת��Ϊ���Ļ�ѧ����ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л���Ľṹ�����ʡ��л�����ƶϣ�Ϊ�߿��������ͣ���Ҫѧ���������չ����ŵ�������ת��������������ѧ���������������ͷ�ɢ˼ά��������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
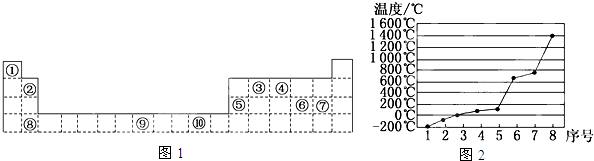
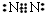 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
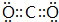
 ���õ���ʽ��ʾ������ C2D ���γɹ���
���õ���ʽ��ʾ������ C2D ���γɹ���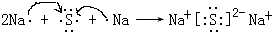 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C8H18��1��+$\frac{25}{2}$O2��g��=8CO2��g��+9H2O��g������H=-48.40kJ/mol | |
| B�� | C8H18��1��+$\frac{25}{2}$O2��g��=8CO2��g��+9H2O��1������H=-5518kJ/mol | |
| C�� | C8H18��1��+$\frac{25}{2}$O2��g��=8CO2��g��+9H2O��l����������H=+5518kJ/mol | |
| D�� | 2C8H18��1��+25O2��g��=16CO2��g��+18H2O��1������H=-11036kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
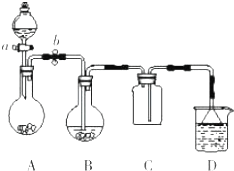 ij��ѧС���������ͼ��ʾװ�ã�����̽��Cu��ŨH2SO4�ķ�Ӧ���ռ�������̬������ȼ��г�װ��ʡ�ԣ���
ij��ѧС���������ͼ��ʾװ�ã�����̽��Cu��ŨH2SO4�ķ�Ӧ���ռ�������̬������ȼ��г�װ��ʡ�ԣ��� �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Tl+���������1������ | B�� | Tl3+�������Ա�Al3+ǿ | ||
| C�� | Tl ���γ�+3�ۺ�+1�۵Ļ����� | D�� | Tl+�Ļ�ԭ�Ա�Agǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ǿ�����ζ������ | |
| B�� | �����Ǿ���Cn��H2O��mͨʽ������ | |
| C�� | ������һ�ְ�ɫ��ĩ������û����ζ | |
| D�� | ��������һ�ֵ��ǵ���Ҫԭ���Ǻ���ȩ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡ����������Һ���Թ��У��μ�3mol��L-1H2SO����Һ�����ԣ�Ȼ��������Һ������A��B�Թ��� | |
| ����2�� | |
| ����3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com