
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶 |

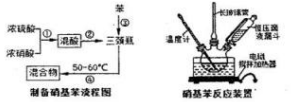
分析 (1)苯与浓硝酸在浓硫酸、50~60℃条件下制备硝基苯;
(2)浓硝酸与浓硫酸混合会放出大量的热,如将浓硝酸加入浓硫酸中,硝酸的密度小于浓硫酸,可能为导致液体迸溅;
(3)反应在50℃~60℃下进行,利用水浴加热控制;温度过高会发生副反应,苯易挥发、硝酸易分解,温度过低反应速率较慢;
(4)混合物倒入蒸馏水中,液体分为三层,生成为苯、中层为水溶液、下层为硝基苯;
(5)步骤⑥是用碳酸钠溶液洗涤酸,若洗涤干净,最后洗涤液中含有碳酸钠,用氯化钙反应检验最后次洗涤液是否含有碳酸根离子;利用蒸馏的方法分离得到更纯的硝基苯;
(6)测定粗产品的密度或熔点判断;
(7)铁粉、稀盐酸与硝基苯反应可生成苯胺,硝基被还原,Fe粉氧化生成氯化亚铁,由元素守恒可知还生成水.
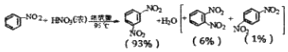
解答 解:(1)制备硝基苯的反应为:C6H6+HNO3$→_{50-60℃}^{浓硫酸}$C6H5NO2+H2O;
故答案为:C6H6+HNO3$→_{50-60℃}^{浓硫酸}$C6H5NO2+H2O;
(2)浓硝酸与浓硫酸混合会放出大量的热,如将浓硝酸加入浓硫酸中,硝酸的密度小于浓硫酸,可能为导致液体迸溅,用20mL浓硫酸与18mL浓硝酸配制混和酸,操作是:在烧杯中先加入18mL浓硝酸,再沿烧杯壁注入20mL浓硫酸,并不断搅拌、冷却,
故答案为:18mL浓硝酸;沿烧杯壁注入20mL浓硫酸;
(3)反应在50℃~60℃下进行,低于水的沸点,可以利用水浴加热控制,偏于可知温度,受热均匀;
温度过高会发生副反应,且苯易挥发、硝酸易分解,温度过低反应速率较慢,控制温度:防止副反应反应等,
故答案为:水浴加热;减少(或防止)副反应发生或减少硝酸分解;
(4)步骤⑤表明混合物中有苯和硝基苯的操作和现象是:混合物倒入蒸馏水中,液体分为三层,其中生成为苯、中层为水溶液、下层为硝基苯,
故答案为:混合物倒入蒸馏水中,液体分为三层;
(5)步骤⑥是用碳酸钠溶液洗涤酸,若洗涤干净,最后洗涤液中含有碳酸钠,取最后一次洗涤液,向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;
为了得到更纯净的硝基苯,还须先向液体中加入无水CaCl2除去水,然后用蒸馏的方法分离,
故答案为:向溶液中加入氯化钙溶液,有白色沉淀生成,说明洗涤干净;蒸馏;
(6)测定粗产品的密度大于1.205g•cm-3,说明“粗产品中2”中含二硝基苯,
故答案为:测定粗产品的密度大于1.205g•cm-3;
(7)铁粉、稀盐酸与硝基苯反应可生成苯胺,硝基被还原,Fe粉氧化生成氯化亚铁,由元素守恒可知还生成水,反应方程式为:Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O,
故答案为:Ph-NO2+3Fe+6HCl→Ph-NH2+3FeCl2+2H2O.
点评 本题考查有机物制备实验,涉及对装置及操作的分析评价、物质的分离提纯、实验基本操作、对数据信息的运用等,难度中等,注意操作规范性及仪器作用、渗透安全意识.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
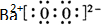 (写电子式).
(写电子式).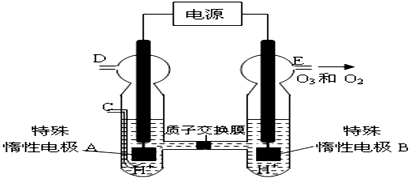
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H11CI的有机物,分子结构中含2个甲基的同分异构体有4种 | |
| B. | CH3COOH与C2H518OH在浓硫酸作用下加热,反应生有机物分子的结构简式为CH3COOC2H5 | |
| C. | 三氯甲烷只有一种结构,不存在同分异构,证明甲烷是正四面体构型 | |
| D. | 煎炸食物的花生油和牛油都是可皂化的饱和醋类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中都有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | 取两小块铝箔,将其中一片打磨,灼烧均能看到铝箔熔化但不滴落的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “神州11号”用Na2O2作氧气的来源,是因为Na2O2能氧化CO2和水产生O2 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作,是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 氨常用作制冷剂利用了氨的化学性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com