

分析 (1)2CuFeS2+O2=Cu2S+2FeS+SO2中,生成1molCu2S转移6mol电子,由Cu2S+O2═2Cu+SO2可知消耗1molCu2S生成2molCu;
(2)由工艺流程可知,A中的反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,B中的反应为4Fe2++O2+4H+=4Fe3++2H2O,C中铁离子循环利用,结合氧化还原反应中氧化剂的氧化性大于氧化产物的氧化物分析;
(3)①由电荷守恒计算x;
②由电子守恒计算R中N元素的化合价,从而判断R;
③由反应可知,参加反应的Cu和消耗的HNO3物质的量之比为3:x.
解答 解:(1)反应2CuFeS2+O2=Cu2S+2FeS+SO2中,化合价变化情况为:Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,则每生成1molCu2S转移电子6mol;由Cu2S+O2═2Cu+SO2可知消耗1molCu2S生成2molCu,所以当第二个反应生成1molCu时,第一个反应转移电子3mol,故答案为:3;
(2)由工艺流程可知,A中的反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,B中的反应为4Fe2++O2+4H+=4Fe3++2H2O,C中铁离子循环利用,
①由上述分析可知溶液A中的反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②A中发生2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,溶液B中发生4Fe2++O2+4H+=4Fe3++2H2O,由氧化剂的氧化性大于氧化产物的氧化性可知氧化性为O2>Fe3+>SO42-,
故答案为:O2>Fe3+>SO42-;
(3)①由电荷守恒可得:(-2)+x=2×3,则x=8,故答案为:8;
②设R中氮元素的化合价为a,由得失电子守恒可得:2×(5-a)=2×3,解得a=+2,则R为NO,故答案为:NO;
③由①和②可知该反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,参加反应的Cu和消耗HNO3的物质的量之比为3:8,故答案为:3:8.
点评 本题以铜及其化合物为载体考查氧化还原反应的计算,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析、计算能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: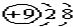 | |
| B. | 乙烷和丙烯互为同系物 | |
| C. | NaCl的电子式:Na${\;}_{×}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | H2、D2、T2属于同位素,化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸,Na2CO3溶液 | B. | 稀H2SO4溶液,NaAlO2溶液 | ||
| C. | Cl2,NaBr溶液 | D. | CO2,澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使品红褪色 | |
| B. | 能使湿润的蓝色石蕊试纸变红 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 | |
| C. | 氢气的燃烧热为241.8 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)=2H2O(l) 的反应热为△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2- | B. | HCO3- | C. | Al3+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com