
A、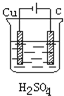 |
B、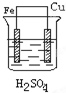 |
C、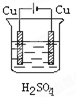 |
D、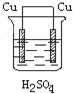 |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验室中制取少量蒸馏水 |
B、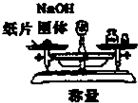 城区一定质量的NaOH固体 |
C、 用滴瓶长期保存NaOH溶液 |
D、 除去乙醇中溶有的少量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③ | B、②⑥ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢气还原氧化铜时,通入氢气立即给氧化铜加热,实验结束,撤掉氢气后停止加热 |
| B、点燃氢气前一定要检验氢气的纯度 |
| C、制取氧气实验结束时,先移去酒精灯,再把导管从水槽中取出 |
| D、皮肤上沾上浓硫酸,立即用氢氧化钠中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
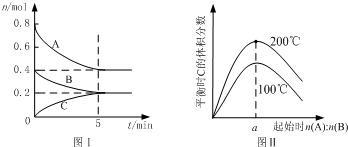
| A、若平衡时A、B的转化率相等,则反应开始A、B的投料比为2:1 |
| B、图Ⅱ所知该反应的△H<0,且a=2 |
| C、若在图Ⅰ所示的平衡状态下,再向体系中充入1molA、0.6molB、3molC,重新达到平衡前v(正)<v(逆) |
| D、200℃时,向容器中充入2mol A 和1mol B,达到平衡时,A 的体积分数小于0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com