
| A.正、逆反应速率都加快 | B.仅逆反应速率加快 |
| C.仅正反应速率加快 | D.正反应速率减慢,逆反应速率加快 |
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是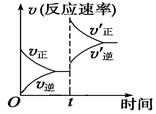
| A.加压 | B.升温 |
| C.增大水蒸气浓度 | D.增大碳的物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
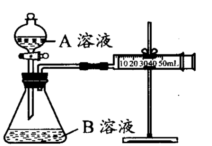
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
| ② | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4) (10-4mol/(L·min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
| 实验步骤及结论: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 块状 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 块状 | 1.0 | 50 | 20 | 35 | 125 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
| A.升高温度,同时增大压强 |
| B.降低温度,同时减小压强 |
| C.增大反应物的浓度,同时使用适宜的催化剂 |
| D.增大反应物的浓度,同时减小生成物的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| 实验组别 | 盐酸浓度(mol/L) | 温度(℃) |
| ① | 2.00 | 15 |
| ② | 2.00 | 30 |
| ③ | 4.00 | 30 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④⑤⑥ | B.①②⑦ | C.②③⑤ | D.②④⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com