
| A. | 用稀硫酸洗掉铜器表面的铜锈 | |
| B. | 用混有少量Fe粉的Cu粉中,加入足量稀盐酸,充分反应后过滤 | |
| C. | 将KCl和MnO2(不溶于水)的混合物,加入足量水溶解,过滤 | |
| D. | 将混有少量CuCl2的FeCl2晶体,加入足量水溶解,过滤 |
分析 A.Cu与稀硫酸不反应,铜锈与硫酸反应;
B.Fe与盐酸反应,Cu与盐酸不反应;
C.KCl溶于水,MnO2不溶于水;
D.二者均溶于水.
解答 解:A.Cu与稀硫酸不反应,铜锈与硫酸反应,则加稀硫酸反应后过滤可除杂,故A正确;
B.Fe与盐酸反应,Cu与盐酸不反应,则加足量盐酸后、过滤可除杂,故B正确;
C.KCl溶于水,MnO2不溶于水,则加入足量水溶解,过滤可除杂,故C正确;
D.二者均溶于水,则溶解、过滤不能除杂,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、分离方法为解答的关键,侧重分析与实验能力的考查,注意分离原理及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯气和水 | B. | 氯化氢和水 | ||
| C. | 二氧化碳和烧碱溶液 | D. | 氯气和烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 甲醇(CH3OH)燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
甲醇(CH3OH)燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
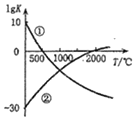 如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:| A. | 只有反应①是放热反应 | |
| B. | 升温,反应①的速率减小反应②的速率增大 | |
| C. | 可以在常温下利用反应①进行工业固氮 | |
| D. | 曲线的交点表示反应①和反应②体系中 N2 的转化率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 3mol/L的NaCl溶液 | B. | 75 mL 2mol/LNaNO3溶液 | ||
| C. | 150 mL 2mol/L的Na2SO4溶液 | D. | 75 mL 1mol/L的Na2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
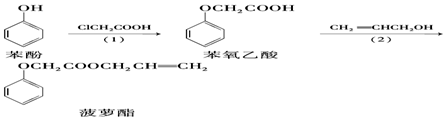
| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| C. | 苯氧乙酸分子中含有醚键、羧基两种官能团 | |
| D. | 步骤(2)产物中残留的烯丙醇可用溴水检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
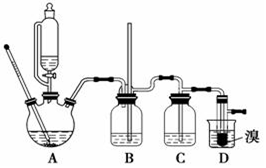 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2$\stackrel{Br_{2}}{→}$BrCH2CH2Br用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2$\stackrel{Br_{2}}{→}$BrCH2CH2Br用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L | B. | 1 mol/L | C. | 0.01 mol/L | D. | 0.22 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com