
| 选项 | 实验操作和现象 | 结论 |
| A | 在酒精灯上加热铝箔,铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色 | 原溶液中含有Fe3+,没有Fe2- |
| C | KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变为蓝色 | NO3-还原为NH3 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氧化铝的熔点高,包裹在Al的外面;
B.先无明显现象,后溶液变成血红色,说明没有铁离子,含有亚铁离子;
C.试纸变为蓝色,说明生成氨气;
D.Na2CO3为强碱弱酸盐,水解呈碱性,与氯化钡反应生成碳酸钡沉淀,碳酸根离子浓度减小.
解答 解:A.氧化铝的熔点高,包裹在Al的外面,则铝箔熔化但不滴落,熔点:氧化铝>铝,故A错误;
B.先无明显现象,后溶液变成血红色,说明没有铁离子,含有亚铁离子,结论相反,故B错误;
C.试纸变为蓝色,说明生成氨气,可说明NO3-还原为NH3,故C正确;
D.Na2CO3为强碱弱酸盐,水解呈碱性,当加入BaCl2后,Ba2++CO32-═BaCO3↓,由于c(CO32-)减小,水解平衡左移,c(OH-)也随之减小,酚酞的红色慢慢消失,故D正确.
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、物质的性质、实验技能为解答关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
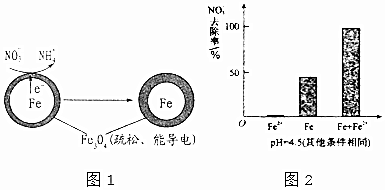
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 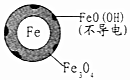 | 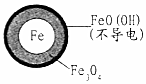 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,9.2gNO2气体中.分子数为0.2NA | |
| B. | pH=2的硫酸溶液中,H+数目为0.01NA | |
| C. | 将0.05molFeCl3全部转化为Fe(OH)3胶体,则胶粒数目为0.05NA | |
| D. | 20gD2O中含有的质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | K37ClO3与浓盐酸在加热条件下生成氯气:37ClO3-+6Cl-+6H+═37Cl-+3Cl2↑+3H2O | |
| D. | 4mol•L-1的NaAlO2溶液与7mol•L-1的盐酸等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沼气是可再生资源,电能是二次能源 | |
| B. | 对“地沟油”进行蒸馏即可得到汽油 | |
| C. | 用焦炭还原铝土矿即可获得金属铝 | |
| D. | 从海水提取物质都必须通过化学反应方可实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
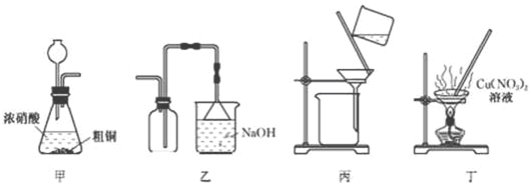
| A. | 用装置中制备NO2 | B. | 用装置乙收集NO2 | ||
| C. | 用装置丙过滤除去固体杂质 | D. | 装置丁蒸发至干得纯净硝酸铜晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 向蛋白质溶液中滴加Pb(NO3)2溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| B | 测定浓度为 0.1mol•L-1CH3COONa与HCOONa 溶液的pH,CH3COONa溶液的pH较大 | 酸性:CH3COOH>HCOOH |
| C | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量0.l mol•L-1AgNO3溶液,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| C | KNO3和KOH 混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
| D | 向两份蛋白质溶液中分别滴加Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
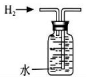 | 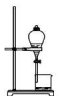 | 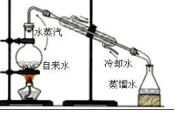 | 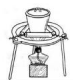 |
| A.排水法收集 H2 | B.分离油和水 | C.实验室制取少量蒸馏水中 | D.从饱和食盐水提取 NaCl晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com