
| A. | 锥形瓶在装待测液前要用待测液润洗2~3次 | |
| B. | 用25mL酸式滴定管量取20.00mLKMnO4溶液 | |
| C. | 测某溶液pH:用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测 | |
| D. | 加热蒸发NaHCO3溶液得纯净的NaHCO3 |
分析 A.滴定时,锥形瓶不能润洗,否则会导致待测液物质的量偏大,测定结果偏高;
B.酸式滴定管下端为玻璃旋塞,可以用于量取一定体积的高锰酸钾溶液;
C.pH试纸测定pH值时,试纸在使用前不能湿润;
D.碳酸氢钠不稳定,受热分解;
解答 解:A.中和滴定时,不能用待测液润洗待测液,否则会导致消耗的标准液体积偏大,沉淀结果偏高,故A错误;
B.碱式滴定管下端为橡胶塞,不能量取具有强氧化性的高锰酸钾溶液,可以用酸式滴定管量取高锰酸钾溶液,故B正确;
C.pH试纸测定pH值时,试纸在使用前不能湿润,容易将溶液稀释测量结果误差较大,故C错误;
D.碳酸氢钠不稳定,受热分解,加热蒸发NaHCO3溶液得到固体为碳酸钠,故D错误;
故选:B.
点评 本题考查了计量仪器的使用方法、pH试纸的使用,掌握常见计量仪器的构造及使用方法,明确pH试纸在使用前不能湿润是解题关键,题目难度不大.


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
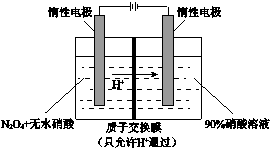
| A. | 阳极电解液中的N2O4可由NO2降温转化制得 | |
| B. | 阳极的电极反应为:N2O4-2e-+2HNO3=2N2O5+2H+ | |
| C. | 阴极的电极反应为:2H++2e-=H2↑ | |
| D. | 每制备1molN2O5,有1molH+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 金属钾与水反应:2K+2H2O═2K++2OH-+H2↑ | |
| C. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5ClBr | B. | C3H6Cl2 | C. | C4H8Br2 | D. | C3H4I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②③④ | C. | ②③⑥ | D. | ④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com