

| A. | c电极的名称为正极,d电极上的电极反应式为CH4-8e-+4O2-═CO2+2H2O | |
| B. | 如图2所示,a电极上的电极反应式为4OH--4e-═2H2O+O2↑ | |
| C. | 如图2所示电解100mL0.5mol/LCuSO4溶液,若a电极产生56mL(标准状况)气体,则所得溶液的pH=1(不考虑溶液体积变化) | |
| D. | 若要使电解质溶液恢复到电解前的状态,可加入Cu2(OH)2CO3 |
分析 依据装置图1中电流流向分析,c为正极,氧气的电子发生还原反应,d为负极,甲烷失电子发生氧化反应;
图2是电解池,与电源正极连接的a电极为阳极,发生4OH--4e-═O2↑+2H2O,b为阴极,发生为Cu2++2e-═Cu,结合电极方程式计算.
解答 解:A.图1是原电池,依据电流流向是从正极流向负极,c电极为正极,d电极为电池负极,d极上甲烷失电子发生还原反应,电极反应为:CH4-8e-+4O2-═CO2+2H2O,故A正确;
B.图2是电解池,与电源正极连接的a电极为阳极,发生4OH--4e-═O2↑+2H2O,故B正确;
C.若a电极产生56mL(标准状况)气体为氧气,物质的量为0.0025mol,消耗氢氧根离子物质的量为0.01mol,溶液中生成氢离子物质的量为0.01mol,c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=-lg0.1=1,故C正确;
D.所得溶液电解过程中CuSO4溶液每损失2个Cu原子,就损失2个 O原子,相当于损失一个CuO,为了使CuSO4溶液,恢复原浓度,应加入CuO,也可以加入CuCO3,符合恢复溶液浓度的定量关系,但不能加入Cu(OH)2、Cu2(OH)2CO3,故D错误.
故选D.
点评 本题考查原电池原理和电解池原理的应用,是中等难度的试题,试题综合性较强,在注重对基础知识巩固和训练的同时,主要是侧重对学生能力的培养,提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | C、N、P | B. | N、O、S | C. | N、P、F | D. | Be、O、S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与甲醇在浓硫酸作用下共热 | B. | 用丙烯与氯化氢反应制氯丙烷 | ||
| C. | 乙醛与银氨溶液共热 | D. | 溴乙烷与NaOH的醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
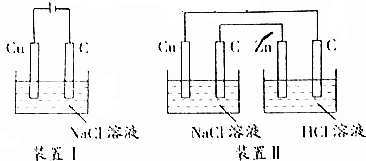
| A. | 装置Ⅰ通电一段时间,可看见溶液变蓝,碳棒上有大量红色物质附着 | |
| B. | 装置Ⅱ能加速铜电极的腐蚀 | |
| C. | 装置Ⅰ将电源换成灵敏电流表,观察到有电流通过 | |
| D. | 装置Ⅰ通电30s后反接电源,再过30s后电极质量未恢复 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:6:2 | B. | 9:3:1 | C. | 6:3:2 | D. | 6:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
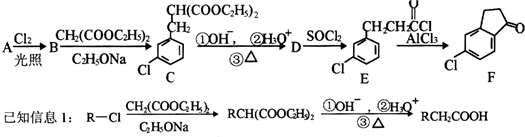
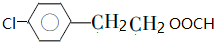 .
.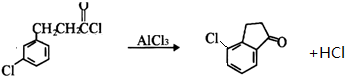 .
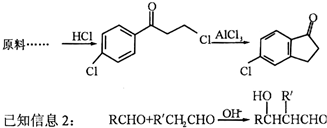
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com