
(9分)如图甲、乙是电化学实验装置。
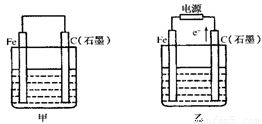
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:
。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
(1)①O2+2H2O+4e-===4OH-(2分) ②2Cl-+2H2O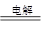 2OH-+H2↑+Cl2↑(2分)
2OH-+H2↑+Cl2↑(2分)
③5Cl2+I2+6H2O===10HCl+2HIO3(2分) (2)①Fe-2e-===Fe2+(1分)
②CuO(或CuCO3) (1分) 0.8(或1.24) (1分)
【解析】(1)①根据装置可知甲是原电池,乙是电解池。由于氯化钠溶液显中性,所以发生吸氧腐蚀,石墨是正极,氧气得到电子,方程式为O2+2H2O+4e-===4OH-。
②根据乙中电子流向可知,石墨和电源的正极相连,作阳极,溶液中的氯离子放电。铁和电源的负极相连,作阴极,溶液中的氢离子放电。所以总反应式为2Cl-+2H2O 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
③5mol氯气得到5mol×2=10mol电子,所以根据电子得失守恒可知,单质碘得到10mol电子,因此碘的化合价从0价升高到+5价,所以氧化产物是HIO3。因此方程式为5Cl2+I2+6H2O===10HCl+2HIO3。
(2)①铁是活泼的金属,作负极,所以电极反应式为Fe-2e-===Fe2+。
②乙中阳极是OH-放电,生成氧气。阴极是铜离子放电,生成铜,总反应式为2CuSO4+2H2O 2H2SO4+2Cu+O2↑。反应中生成氢离子的物质的量是0.2L×0.1mol/L=0.02mol,所以根据方程式可知生成铜是0.1mol,因此要使溶液恢复到电解前的状态,可向溶液中加入0.01mol氧化铜或0.01mol碳酸铜,其质量方便是0.8g、1.24g。
2H2SO4+2Cu+O2↑。反应中生成氢离子的物质的量是0.2L×0.1mol/L=0.02mol,所以根据方程式可知生成铜是0.1mol,因此要使溶液恢复到电解前的状态,可向溶液中加入0.01mol氧化铜或0.01mol碳酸铜,其质量方便是0.8g、1.24g。


科目:高中化学 来源: 题型:
(本小题满分9分) 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:
(1)实验1甲针筒内的现象是:有___________生成,针筒活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(2)实验2中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为____________________。
(3)实验3中,已知:3Cl2+2NH3===N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省南安一中高一下学期期中考试化学试卷(带解析) 题型:实验题
(本小题满分9分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:

(1)实验1甲针筒内的现象是:有___________生成,针筒活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(2)实验2中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为____________________。
(3)实验3中,已知:3Cl2+2NH3===N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖北宜昌金东方学校高二上学期期末考试化学试卷(带解析) 题型:填空题
(9分)如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:
。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为 。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高一第一学期期中考试化学试卷 题型:实验题
(本小题满分9分) 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:


(1)实验1甲针筒内的现象是:有___________生成,针筒活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________溶液中。
(2)实验2中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为____________________。
(3)实验3中,已知:3Cl2+2NH3===N2+6HCl。甲针筒处活塞有移动,针筒内有白烟产生外,气体的颜色变为____________。最后针筒内剩余气体的体积约为________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com