
【题目】下列现象中,其原因与氢键存在无关的是( )
A.水的熔沸点比H2S高
B.HCl的熔沸点比HI低
C.NH3极易溶于水
D.邻位羟基苯甲醛的沸点比对位羟基苯甲醛沸点低
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为40%
C. x=2
D. 达到平衡状态时,C的体积分数为1/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g)+2B(s) ![]() yC(g) ΔH<0
yC(g) ΔH<0
在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)根据图示可确定x∶y=________。
(2)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(3)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(4)写出反应的平衡常数表达式________,平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 很多鲜花和水果的香味来自于酯 B. 甲烷和苯都可通过石油分馏得到
C. 糖类和油脂在一定条件下均能水解 D. 棉花和蚕丝的主要成分是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿渣所含各物质的质量分数如下表所示:
成分 | SiO2 | MgO | Fe2O3 | Al2O3 | CuO |
质量分数/% | ? | 4.0 | 32 | 10.2 | 16 |
已知常温下,几种氢氧化物开始沉淀和完全沉淀的pH如下表所示:
Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |
某课题组拟以上述矿渣为原料制备金属、铝、铜、铁,其部分工艺流程如下:
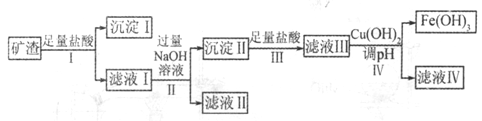
请回答下列问题:
(1)沉淀I的主要用途是_______(答一条即可),步骤IV中调节pH范围为______。
(2)由滤液II经几步反应可得到需要制备的一种金属的氧化物,滤液II中需要通入气体的化学式为__________。
(3)写出由滤液I得到滤液II的离子方程式:______________。
(4)滤液IV中含有的金属阳离子是__________,分离金属阳离子的操作是____________。
(5)工业上,冶炼铝、铁、铜、镁的方法依次是_______(填字母)。
A.电解法、热还原法、分解法、分解法
B.电解法、热还原法、热还原法、电解法
C.热还原法、分解法、电解法、电解法 .
D.热还原法、热还原法、热还原法、电解法
(6)工业上冶炼铝、铁、铜、镁时选用的相应的原料为___________(填字母)。
A.Al2O3、Fe2O3、CuO、MgO
B.Al2O3、Fe2O3、CuCl2、MgCl2
C.AlCl3、FeCl3、CuO、MgCl2
D. Al2O3、Fe2O3、CuO、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.金刚石晶体中的最小碳原子环由12个碳原子构成
B.AlCl3晶体属于分子晶体
C.1molSiO2分子中含4molSi—O键
D.金刚石化学性质稳定,即使在高温下也不会和O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 3Z(g)。此反应达到平衡的标志是( )
3Z(g)。此反应达到平衡的标志是( )
A. 容器内压强不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l:2:3
D. 单位时间消耗0.1molX同时生成0.3molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:N2(g)+3H2(g)![]() 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol H2、 2 mol N2 | 6 mol H2、 4 mol N2 | 2 mol NH3 |
达到平衡的时间/min | 5 | 8 | |
平衡时N2的浓度/(mol·L1) | c1 | 1.5 | |
NH3的体积分数 | φ1 | φ2 | |
混合气体的密度/(g·L1) | ρ1 | ρ2 |
下列说法不正确的是
A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3 mol·L1·min1
B.在该温度下甲容器中反应的平衡常数K=![]()
C.2ρ1=ρ2
D.2c1<1.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com