
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 17g氨气所含电子数目为8NA | |
| C. | 将1体积c1mol/L的硫酸溶于4体积水中,稀溶液的浓度为0.2c1mol/L | |
| D. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 |
分析 A.依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算解答;
B.质量转化为物质的量,结合1个氨气含有10个电子解答;
C.混合后溶液体积发生改变;
D.物质的量浓度中,体积为溶液体积,非溶剂体积.
解答 解:A.常温常压下,4g H2含有的分子数为$\frac{4g}{2g/mol}$×NA=2NA,故A正确;
B.17g氨气所含电子数目为$\frac{17g}{17g/mol}$×10×NA=10NA,故B错误;
C.硫酸与水的密度不同,所以1体积硫酸与4体积水混合,溶液体积不等于5体积,故C错误;
D.将5.85gNaCl晶体溶入100mL水中,得到溶液体积大于100mL,所得溶液物质的量浓度小于0.1mol/L的NaCl,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意物质的量浓度概念的理解,题目难度不大.


科目:高中化学 来源: 题型:解答题
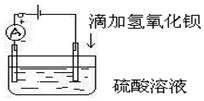 如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电性的关系.
如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电性的关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:NaH>H2O>H2S | D. | 硬度:SiC>石墨>CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| B | 苯(苯酚) | 饱和溴水 | 过滤 |
| C | 乙烷(乙烯) | 溴水 | 洗气 |
| D | 乙烯(二氧化硫) | 酸性高锰酸钾溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FexO溶于足量盐酸后只生成了FeCl3和H2O | |
| B. | 标准状况下112 mL Cl2的物质的量是5 mol | |
| C. | x=0.8 | |
| D. | 通入Cl2后,发生反应的离子方程式:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠 | |
| B. | “出汗”是因为生成的氢氧化钠吸收空气中的CO2在表面形成了溶液 | |
| C. | 最后变成碳酸钠粉末 | |
| D. | 该过程中的所有化学反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,可用来干燥H2S | B. | 浓硫酸在常温下不与铁和铝反应 | ||
| C. | 可将蒸馏水注入浓硫酸进行稀释 | D. | 棉花接触浓硫酸后会变黑 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com