
【题目】室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
A.NH ![]() 、Cu2+、Cl﹣、NO
、Cu2+、Cl﹣、NO ![]()
B.K+、Na+、CO ![]() 、S2﹣
、S2﹣
C.K+、Na+、CH3COO﹣、SO ![]()
D.Ba2+、Mg2+、HCO ![]() 、Cl﹣
、Cl﹣
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.凡是放热反应的发生均无需加热
B.凡是需要加热后才能发生的反应是吸热反应
C.伴有能量变化的物质变化都是化学变化
D.物质发生化学反应都伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关乙醇(C2H5OH)的说法正确的是( )
A.乙醇是食醋的主要成分
B.C2H5OH中
C.H、O元素的质量比是2:6:1C.乙醇不能溶于水
D.C2H5OH中C元素的质量分数是 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。

供选试剂:30%H2O2溶液、0.lmol/LH2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 | 现象 | |
甲 | 向I的锥形瓶中加入_____,向I的_________中加入30%H2O2溶液,连接I、. Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1 mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是___________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________________。为进一步探究该条件对反应速率的影响,可采取的实验措施是___________________________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列__________ (填字母)溶液,证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeC12 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O==2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应,3I2+6OH-==5I-+IO3-+3H2O造成的。请设计实验证明他们的猜想是否正确:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )
A.用pH试纸测双氧水的pH
B.用托盘天平称取5.85gNaCl晶体
C.用酸式滴定管量取20.00mL酸性K2Cr2O7溶液
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知31g白磷(P4)变为31g红磷(P)时释放能量。上述变化属于__变化(填“物理”或“化学”);稳定性白磷__红磷(填“>”或“<”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应判断还原剂的还原性由强到弱的顺序正确的是
① C+H2O=CO+H2 ② C+CO2=2CO ③ CO+H2O=CO2+H2
A. C>H2>CO B. C>CO>H2 C. H2>C>CO D. CO>H2>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作.下列图示对应的装置合理、操作规范的是( )
A.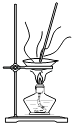
灼烧
B.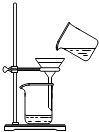
过滤
C.
分液
D.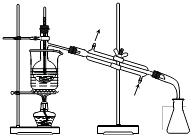
蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的废料(含MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备MnO2,实现锰的再生利用。其工艺流程如下:

已知:①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
②金属离子(起始浓度为0.1 mol·L-1)生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
回答下列问题:
(1)酸浸过程中MnO2与浓盐酸反应的离子方程式为_____________________________。
(2)滤液①中铁以Fe3+存在,Fe2+转化为Fe3+过程中,可能发生反应的离子方程式为____________________(写出1种即可)。
(3)除铁的方法是:向滤液①中加MnCO3调节溶液pH,其范围是______________________;过滤得滤液②。
(4)将滤液③转化为MnO2的方法常用氧化法和电解法。
①氧化法的具体做法是向所得溶液中加入酸化的NaC1O3将Mn2+氧化为MnO2,该反应的离子方程式为_____________________________________。
②电解法生成MnO2的电极反应式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com