
| 温度 | 300 | 727 | 1227 |
| lgK | 6.17 | 2.87 | 1.24 |



| x |
| a-x |
| x |
| a |
| SO | 2- 4 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、pH=1 盐酸为介质 |
| B、pH=3 硫酸为介质 |
| C、pH=5 次氯酸为介质 |
| D、pH=12 氢氧化钠为介质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g Mg与足量的二氧化碳完全反应失去的电子数为0.2NA |
| B、22.4 L氯气与过量的铁完全反应,转移电子数为2NA |
| C、含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2:3 |
| D、1.8g 1H218O中含有的中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、比例模型为: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |||
B、2CH3CH2OD+O2
| |||
| C、二氧化硫、氨、煤的液化均为物理变化 | |||
D、实验室中制取乙酸乙酯的方程式为:CH3COOH+H18O-C2H5
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
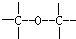 ④
④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com