

分析 (1)根据盖斯定律和热化学方程式的意义和书写方法,(①+②)×$\frac{1}{2}$得到热化学方程式;
(2)①图象分析,甲醇含量随温度变化的曲线特征,开始反应进行,平衡后,升温平衡逆向进行,根据温度对化学平衡移动的影响知识来回答;
②三段式来计算平衡浓度,根据化学反应速率v=$\frac{△c}{△t}$以及平衡常数的表达式计算,0~10min内,二氧化碳的平均反应速率=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/(L•min),所以氢气的反应速率是3×0.075mol/(L•min)=0.225mol/(L•min),
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
初始浓度:1 3 0 0
变化浓度:0.75 2.25 0.75 0.75
平衡浓度:0.25 0.75 0.75 0.75
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;并根据压强对化学平衡移动的影响知识来回答;
(3)①溶液中铵根离子水解显示酸性,硝酸铵溶液中滴加适量的NaOH溶液溶液的pH=7,则氢离子和氢氧根离子浓度相等,根据电荷守恒来计算;
②电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则电解方程式为5SO2+2NO+8H2O$\frac{\underline{\;电解\;}}{\;}$(NH4)2SO4+4H2SO4,根据电解方程式结合电解原理分析
解答 解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
由盖斯定律(①+②)×$\frac{1}{2}$得到热化学方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=$\frac{1}{2}$(-574kJ•mol-1-1160kJ•mol-1)=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
(2)①根据图象分析知道:温度升高,甲醇的体积分数φ(CH3OH)减小,平衡逆向移动,所以反应是放热的,即△H<0,
故答案为:<;
②0~10min内,二氧化碳的平均反应速率=$\frac{1.0mol/L-0.25mol/L}{10min}$=0.075mol/(L•min),所以氢气的反应速率是3×0.075mol/(L•min)=0.225mol/(L•min),
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
初始浓度:1 3 0 0
变化浓度:0.75 2.25 0.75 0.75
平衡浓度:0.25 0.75 0.75 0.75
所以平衡常数K=$\frac{0.7{5}^{2}}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$向该容器中再充入1mol CO2和3mol H2,会使得压强增大,平衡正向移动,所以再次达到平衡时CH3OH(g)的体积分数变大,
故答案为:0.225;$\frac{16}{3}$;变大;
(3)①硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(NO3-)+c(OH-),则c(Na+)+c(H+)<c(NO3-)+c(OH-),
故答案为:<;
②电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则电解方程式为5SO2+2NO+8H2O$\frac{\underline{\;电解\;}}{\;}$(NH4)2SO4+4H2SO4,由电解方程式可知,物质A为硫酸,其的化学式H2SO4; 电解时,阳极上二氧化硫失电子生成硫酸根离子,则阳极的电极反应式是SO2+2H2O-2 e-═SO42-+4H+,阴极反应式为:NO+5e-+6H+=NH4++H2O,
故答案为:H2SO4;NO+5e-+6H+=NH4++H2O.
点评 本题考查较为综合,涉及化学平衡计算、反应热与焓变、电解原理、化学平衡的影响等知识,题目难度较大,明确化学平衡及其影响为解答关键,注意掌握盖斯定律的内容及应用方法.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3$\stackrel{电解}{→}$ Al$→_{高温}^{Fe_{2}O_{3}}$ Fe | |
| B. | S$\stackrel{O_{2}/点燃}{→}$ SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| C. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$ Cu | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$ FeCl3(aq)$\stackrel{△}{→}$ 无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
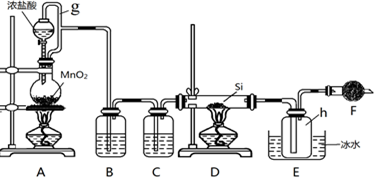
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 治疗疟疾的青蒿素(如图),分子式为C15H20O5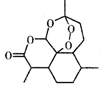 | |
| B. | 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种 | |
| C. | 对三联苯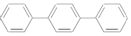 分子中至少有16个原子共平面 分子中至少有16个原子共平面 | |
| D. | 油脂和乙烯在一定条件下都能与水反应,且反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
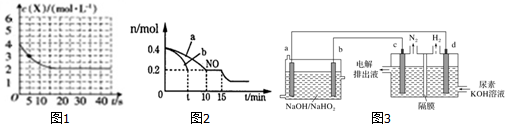
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:a<c<d<e | |
| B. | 气态氢化物的稳定性e<b<c | |
| C. | 最高价氧化物的水化物酸性b>e | |
| D. | c和d形成的化合物溶于水后溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com