
| A. | pH=2的盐酸溶液中含有的阳离子数为0.02NA | |
| B. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| C. | 标准状况下,22.4L CHCl3所含有的分子数目为NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应转移的电子数目均为3NA |
分析 A、溶液体积不明确;
B、Fe2+被氧化为Fe3+;
C、标况下,三氯甲烷为液态;
D、求出铝的物质的量,然后根据反应后铝元素变为+3价来分析.
解答 解:A、溶液体积不明确,故溶液中含有的阳离子的物质的量以及个数无法求算,故A错误;
B、Fe2+被氧化为Fe3+,1molFe2+失1mol电子,即NA个,故B错误;
C、标况下,三氯甲烷为液态,不能根据气体摩尔体积来求算,故C错误;
D、27g铝的物质的量为1mol,而无论与盐酸还是氢氧化钠溶液反应后铝元素均变为+3价,故1mol铝均失去3mol电子,即3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| D. | 施肥时,草木灰(有效成分为K2CO3)和NH4Cl混合使用,会产生氨气降低肥效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 实验室制备氢氧化铁胶体:Fe3++3H2O═Fe(OH)3(胶体)+3H+ | |
| D. | 向苯酚钠溶液中通入少量的二氧化碳气体:2C6H5ONa+CO2+H2O═2C6H6O+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 非金属性越强,其气态氢化物越稳定 | 稳定性:NH3>PH3 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片中分别加入足量的浓、稀硝酸,浓硝酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | HF沸点低于HCl |
| D | 浓硫酸不能干燥具有还原性的气体 | 浓硫酸不可以干燥SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
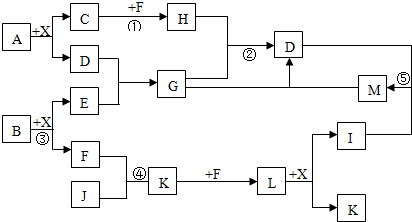
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
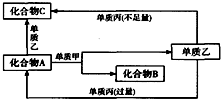 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH
 .⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种.
.⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种. .
. .
. .
.

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com