
(6分)A、B、C三种金属单质和气体甲、乙、丙及物质D、E、F、G之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以下信息回答下列问题:
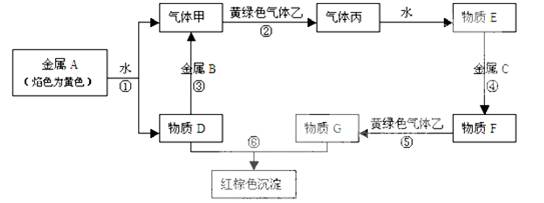
(1)写出下列物质的化学式:A 、乙
(2)按要求写出下列反应的方程式:
反应③的化学方程式: [
反应④的离子方程式: [
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:阅读理解
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:
A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:| C | |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:
 北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:
北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修6 6.2镀锌铁皮锌镀层厚度的测定练习卷(解析版) 题型:实验题
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40 mL 6 mol·L-1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是
________________________________________________________________________。
(2)如何检验铁片已经洗净
________________________________________________________________________
________________________________________________________________________。
(3)该小组的实验数据记录及数据处理如下,完成下列表格。(锌的密度为7.14 g/cm3)
|
|
数据记录 |
数据处理 |
||||
|
镀锌铁皮 |
长度/cm |
宽度/cm |
镀锌铁皮质量/g |
铁皮质量/g |
锌镀层厚度(单侧)/cm |
锌镀层平均厚度(单侧)/cm |
|
A |
5.00 |
4.90 |
4.460 |
4.313 |
4.201×10-4 |
|
|
B |
5.10 |
5.00 |
4.421 |
4.267 |
4.229×10-4 |
|
|
C |
5.20 |
5.00 |
4.640 |
4.467 |
4.660×10-4 |
计算镀锌铁皮锌镀层平均厚度(单侧)________cm。本实验中产生误差的地方可能有哪些(任意列举两
种)________________________________________________________________________
________________________________________________________________________、
________________________________________________________________________。
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH-+2H2O===[Zn(OH)4]2-+H2↑。某同学按下图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮放入6 mol·L-1 NaOH溶液中。回答下列问题。

(4)装置中导管a的作用是
________________________________________________________________________
________________________________________________________________________。
(5)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。上述操作的顺序是
____________________________________________________(填序号)。
(6)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(实验条件下的气体摩尔体积为Vm L·mol-1)。则镀锌铁皮的厚度为
________________________________________________________cm。(写出数学表达式)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三第二次月考化学试卷 题型:选择题
(20分)A、B、C三种常见物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)。

(1)若A是一种两性氧化物,B的水溶液呈酸性,C的水溶液呈
碱性,请写出A、B、C三种物质中含有的同一种金属元素的原子
结构示意图_ B溶液显酸性的原因(用离子方程式
表示) ,反应④的离子方程式 。
(2)若A为一种金属单质时,反应①②③均为化合反应,反应④为置换反应。请写出③可能的离子方程式 和工业冶炼A的化学方程式_ 。
(3)若A、B、C是三种不同类别的气态物质,均能被同一种单
质氧化,写出实验室采用右图所示装置制取A的化学方程式________,
 检验A气体是否集满的方法是
。
检验A气体是否集满的方法是
。
(4)若A、B、C是三种不同类别的固态物质,C是一种既含有离子
键又含有共价键的化合物,溶于水电离出两种相同电子数的离子,
B是工业上制取A、C的原料。实验室保存少量单质A的方法是____ 。写出工业采用B制取C的离子方程式___ ;浓度均为0.5 mol.L-1的B、C溶液,导电能力比较强的是________(填化学式)溶液。
(5)若A、B均是可燃性物质,完全燃烧都生成气体C,
常温下A溶液pH<7,将C通入A溶液中,pH值先增
大后减小。

①将C通入右图所示装置中,可以制得强电解质D的溶液,写出气体C发生的电极反应式
②该装置中H+的作用是 和
③若转移的电子数为6.02×1022时,左槽n(H+)的变化量
为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com