
【题目】电解饱和食盐水可以产生氯气、氢气和氢氧化钠,氯气与石灰乳反应可制漂白粉:2Cl2 +2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(1)请写出电解饱和食盐水的化学方程式,若为氧化还原反应则用单线桥标出电子转移的方向和数目_______________。
(2)若电解饱和食盐水时消耗NaCl 58.5g,试计算理论上最多可得到氯气的体积(标准状况)为多少__________?
(3)若将1mol氯气通入石灰乳中,理论上可得到Ca(ClO)2的质量是多少_______?
【答案】 11.2L 71.5g
11.2L 71.5g
【解析】
依据电解反应的化学方程式和电极反应,结合电解过程中电子守恒计算,化学方程式的计算。
(1)电解饱和食盐水发生的反应为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,氯元素化合价由-1价升为0价被氧化,氢元素由+1价除为0价被还原,转移电子数为2,用单线桥标出电子转移的方向和数目如下:
2NaOH+H2↑+Cl2↑,氯元素化合价由-1价升为0价被氧化,氢元素由+1价除为0价被还原,转移电子数为2,用单线桥标出电子转移的方向和数目如下: ;
;
(2)电解饱和食盐水发生的反应为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
若电解饱和食盐水时消耗NaCl58.5g,反应的氯化钠物质的量=![]() =1mol;依据化学方程式计算得到:氯气物质的量为0.5mol,标准状况下氯气体积为11.2L;
=1mol;依据化学方程式计算得到:氯气物质的量为0.5mol,标准状况下氯气体积为11.2L;
(2)若将1mol氯气通入足量石灰乳中发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;1molCl2完全反应生成次氯酸钙物质的量为0.5mol,则次氯酸钙质量=0.5mol×143g/mol=71.5g。


科目:高中化学 来源: 题型:
【题目】已知:①Na2SO3+2H2O+I2=Na2SO4+2HI; ②Cl2+2Fe2+=2Fe3++2Cl-;③I2+Fe2+不反应,向含SO32-、Fe2+、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写不正确的是
A. 铁片放入稀硫酸溶液中:2Fe+6H+==2Fe3++3H2↑
B. 氢氧化镁与稀硫酸的反应:Mg(OH)2+2H+==Mg2++2H2O
C. Al(OH)3与盐酸的反应:Al(OH)3+3H+==Al3++3H2O
D. 铜与氯化铁溶液的反应:2Fe3++Cu==2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是橙色的酸性K2Cr2O7水溶液遇乙醇迅速生成绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧衍生物
A.②④B.②③C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A.酯化反应也属于加成反应
B.酯化反应中羧酸脱去羧基中的羟基,醇脱去羟基中的氢原子生成水
C.浓硫酸在酯化反应中只起催化剂的作用
D.欲使酯化反应生成的酯分离并提纯,可以将酯蒸气通过导管伸入饱和碳酸钠溶液的液面下,再用分液漏斗分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀有金属铟由于其良好的性能常用于生产液晶显示器和平板屏幕,下图是铟元素的相关信息,下列有关铟的说法错误的是
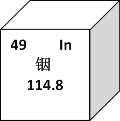
A. 115In原子核内有66个中子
B. 115In原子核外有49个电子
C. 115In、113In互为同位素
D. 115In、113In的化学性质有较大的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是

A. 甲胺在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH—
CH3NH3++OH—
B. b点对应的加入盐酸的体积小于20mL
C. 将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,得到对应a点的溶液
D. 常温下,甲胺的电离常数为Kb,则pKb=—lgKb=3.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO(溶于酸,微溶于强碱溶液)在工业上用途广泛,可制作颜料铅白、杀虫剂等。某再生能源企业以含铅废料(主要含Pb、PbO、PbSO4和极少量的PbO2)和稀H2SO4为原料制备高纯PbO的工艺流程如下:

(1)含铅废料中的PbO2和PbSO4中,铅的化合价分别为____________、____________。
(2)酸溶过程中为了加快溶解速率,除了加入FeSO4作催化剂外,还可采取的措施有____________________(任写一种)。
(3)滤液A中含有的主要阳离子是____________________(填离子符号)。
(4)脱硫过程发生的主要反应的离子方程式为________________________________。
(5)冷却、过滤后对所得的固体进行洗涤操作,在实验室洗涤时,所用到的玻璃仪器有烧杯、_________和_________,检验沉淀是否洗涤干净的方法是________________________________。
(6)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。
NaHPbO2(aq)。PbO的溶解度曲线如图所示。结合该曲线,简述由粗品PbO得到高纯PbO的操作:_______________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com