




分析 (1)乙二醇(I)和水的汽化热都为44KJ.mol-1,其燃烧热△H=-1824kJ.mol-1.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合盖斯定律计算得到乙二醇(g)完全燃烧生成气态水的热化学方程式;
(2)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,据此判断;
(3)①草酸为二元弱酸,分步电离,H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,图象分析可知,当c(H2C2O4)?c(HC2O4-),Ka1=c(H+)1,当c(HC2O4-)?C(C2O42-)Ka2=c(H+)2;在K2C2O4溶液中通入少量SO2发生反应,依据电离平衡常数分析可知,反应生成草酸氢根离子和亚硫酸氢根离子;
②草酸氢钾溶液加中氨水升至6的过程中反应生成草酸铵、草酸钾和水;
③a.根据物料守恒判断;
b.根据电荷守恒判断;
c.根据物料守恒、电荷守恒判断;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些;
④在草酸溶液中滴加酸性高锰酸钾溶液发生反应,速率显增大,后减小是反应生成的锰离子对反应起到了催化作用,随反应进行浓度减小,反应速率减小;
⑤K2C2O4溶液中C2O42-离子水解溶液呈碱性,滴入酚酞变红色,可以加热的方法观察溶液红色变化判断溶液中存在水解平衡;
解答 解:(1)①CH2(OH)CH2(OH)(l)=CH2(OH)CH2(OH)(g)△H=+44KJ/mol,
②H2O(l)=H2O(g)△H=+44KJ/mol,
③CH2(OH)CH2(OH)(l)+$\frac{5}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-1824KJ/mol;
结合盖斯定律③-①+3×②得到CH2(OH)CH2(OH)(g)+$\frac{5}{2}$O2(g)=2CO2(g)+3H2O(g)△H=-1736KJ/mol,
故答案为:CH2(OH)CH2(OH)(g)+$\frac{5}{2}$O2(g)=2CO2(g)+3H2O(g)△H=-1736KJ/mol;
(2)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,故曲线甲对应的压强是P(甲)=3.5MPa,
故答案为:3.5MPa;
(3)①草酸为二元弱酸,分步电离,H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,图象分析可知,当c(H2C2O4)?c(HC2O4-),Ka1=c(H+)1,当c(HC2O4-)?C(C2O42-)Ka2=c(H+)2,Ka1=6.3×10-2,则Ka2=c(H+)2=6.3×10-5,已知H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7.在K2C2O4溶液中通入少量SO2发生反应生成草酸氢钾、亚硫酸氢钾,反应的离子方程式为:SO2+H2O+C2O42-=HC2O4-+HSO3-,
故答案为:6.3×10-5,SO2+H2O+C2O42-=HC2O4-+HSO3-;
②草酸氢钾溶液加中氨水升至6的过程中反应生成草酸铵、草酸钾和水,反应的离子方程式为:HC2O4-+NH3.H2O=NH4++C2O42-+H2O,
故答案为:HC2O4-+NH3.H2O=NH4++C2O42-+H2O;
③A.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故A正确;
B.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故B错误;
C.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,c(Na+)=c(C2O42-)-c(H2C2O4),故C正确;
D.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故D正确;
故答案为:B;
④在草酸溶液中滴加酸性高锰酸钾溶液发生反应,速率显增大,后减小,t1-t2反应速率随时间变化的可能原因是反应生成的锰离子对反应起到了催化作用,随反应进行浓度减小,反应速率减小;
故答案为:反应生成的Mn2+可作该反应的催化剂,加快了反应的进行;
⑤K2C2O4溶液中C2O42-离子水解溶液呈碱性,滴入酚酞变红色,实验设计为:取少量K2C2O4溶液滴加酚酞溶液,溶液呈红色,加热,若溶液颜色加深,说明K2C2O4溶液中存在水解平衡
故答案为:取少量K2C2O4溶液滴加酚酞溶液,溶液呈红色,加热,若溶液颜色加深,说明K2C2O4溶液中存在水解平衡.
点评 本题考查了热化学方程式书写,物质制备方法和实验过程分析判断,图象分析、电解质溶液中离子浓度大小比较,电荷守恒的分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
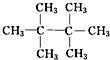
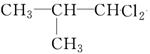 、
、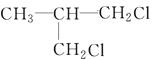 、
、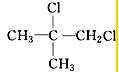 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 单质 | 氧化物 | 混合物 | 胶体 | 电解质 | 非电解质 |
| 属于该类的物质 | ② | ④ | ⑧⑨ | ⑦ | ③⑤⑥ | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com