
有铁和铝的混合物共5.5g,完全溶解于200mL 36.5%的浓盐酸(密度为1.2 g/mL)中,在标准状况下共收集到4.48L H2,求:
(1)浓盐酸的物质的量浓度为 。
(2)铁的质量为 ,铝的质量为 。
(3)将反应后剩余的溶液,用水稀释至500mL,求稀释后溶液中盐酸的物质的量浓度(HCl挥发忽略不计) 。
(1)12mol·L-1(2)2.8g 2.7g (3)4mol·L-1
解析试题分析:(1)根据c= 可知
可知
200mL 36.5%的浓盐酸(密度为1.2 g/mL)溶液的物质的量浓度c= =12mol/L
=12mol/L
(2)设混合物中铁和铝的物质的量分别是a和b
标准状况下共收集到4.48L H2
则氢气的物质的量n= =
= =0.2mol
=0.2mol
根据反应的方程式可知
Fe+2HCl=FeCl2+H2↑
1 2 1
a 2a a
2Al+6HCl=2AlCl3+3H2↑
2 6 3
b 3b  b
b
所以56g/mol×a+27g/mol×b=5.5g、a+ b=0.2mol
b=0.2mol
解得x=0.05mol、b=0.1mol
因此铁和铝的质量分别是0.05mol×56g/mol=2.8g、27g/mol×0.1mol=2.7g
(3)原溶液中氯化氢的物质的量=0.2L×12mol/L=2.4mol
反应中消耗氯化氢的物质的量=2a+3b=0.4mol
所以剩余氯化氢的物质的量=2.4mol-0.4mol=2.0mol
因此稀释后溶液中盐酸的物质的量浓度CB=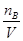 =
= =4mol/L
=4mol/L
考点:考查金属混合物与盐酸反应的有关计算


科目:高中化学 来源: 题型:填空题
过氧乙酸是一种弱酸性氧化剂,广泛用作漂白剂和高效杀菌消毒剂等。
Ⅰ、制备:冰醋酸与H2O2浓溶液按体积比1:1混合,加入适量浓硫酸,控制温度5℃~30℃,搅拌30min并静置4~6h。
反应原理为:H2O2+CH3COOH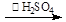
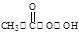 (过氧乙酸)+H2O
(过氧乙酸)+H2O
Ⅱ、含量测定:称取5.0000g过氧乙酸试样(液体),稀释至100mL备用。取上述稀释后过氧乙酸试样5.00mL,用0.0100 mol·L-1KMnO4溶液滴定到终点以除去其中的H2O2,随即加入10%KI溶液10mL,加入0.5%淀粉溶液3滴,摇匀,并用0.0500 mol·L-1Na2S2O3标准溶液滴定到蓝色刚好褪去(离子反应方程式为:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3标准溶液的总体积为20.00mL。
(1)制备过氧乙酸时,温度不宜过高,其原因可能是 。
(2)稀释样品时,除用到容量瓶及烧杯外,还用到的玻璃仪器有 、 。
(3)过氧乙酸溶液与KI反应的离子方程式为 。
(4)通过计算确定原试样中过氧乙酸的质量分数(写出计算过程)。 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将50.0g含有NH4NO3、(NH4)2SO4及其它难溶物的混合物样品,溶于水,过滤后加入足量浓NaOH溶液共热,在标准状况下收集到13.44 L氨气,再向溶液中加入足量BaCl2溶液,产生沉淀46.6g,试计算混合物中NH4NO3的物质的量及(NH4)2SO4的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
① Na2SO4+ 4C→ Na2S+ 4CO↑ ② Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
完全中和50ml物质的量浓度为2mol/LNaOH溶液需要H2SO4的质量是多少?若将这些H2SO4溶于水配成500ml溶液,求H2SO4的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知反应:SO2+Cl2+2H2O=2HCl+H2SO4,若反应过程中消耗SO2标准状况下2.24L,
则:(1)求转移电子的数目。
(2)反应后溶液中H+的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向100 mL水中投入K和Al共15 g,充分反应后,剩余金属为1.8 g
(1)计算放出H2多少升(标准状况下)
(2)过滤出未反应的金属,向滤液中逐滴加入4 mol/L 的 H2SO4 溶液,生成沉淀的最大值是多少,此时消耗 H2SO4 溶液的体积是多少?
(3)生成沉淀后,再加入H2SO4 溶液,使沉淀刚好完全溶解,此时消耗 H2SO4 溶液的体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
现欲配制100 mL 1.0 mol/L的硫酸铜(CuSO4)溶液,试求:
(1)若用无水硫酸铜配制,则需要无水硫酸铜粉末的质量是多少?
(2)若用5.0 mol/L CuSO4溶液配制,则需要该溶液多少毫升?
(3)若用胆矾(CuSO4 5H2O)配制,则需要胆矾的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差。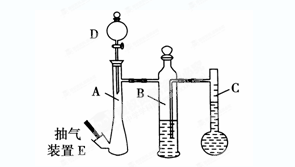
(1)若称取0.113g镁带与10.00 mL稀硫酸(足量)完全反应制取氢气,并测定1mol H2的体积(在常温常压下测定)。反应结束时C中的液面刻度为128.00 mL(A中未加硫酸时C中无液体),则得此条件下1mol H2的体积为________L(精确到0.001)。
(2)上述测出1mol H2的体积比该温度和压强下的理论值偏高的原因是(假设操作和装置都无问题)________(选填编号,下同)
A.未冷却到室温 B.反应太快
C.装置气密性不好 D.B装置漏气
(3)若利用上述装置测定CO2的气体摩尔体积。
①B中所盛放的液体应为________。
A.饱和Na2CO3溶液 B.饱和NaHCO3溶液
C.水 D.澄清石灰水
②仪器A、D中盛放的试剂应为________。
A.大理石,浓盐酸 B.纯碳酸钠,稀硫酸
C.纯碳酸钙,稀硫酸 D.纯碳酸钠,稀盐酸
(4)用以上装置测出的气体摩尔体积均比理论值大,你认为减小实验误差可行的措施是_______。
A.把A装置浸入盛水(常温)的水槽中
B.减小酸的浓度
C.把A装置浸入盛热水的水槽中
D.增大酸的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com