
��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g) 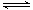 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
|
ʱ��(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K= ��
��֪��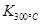 ��
��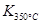 ����÷�Ӧ�� �ȷ�Ӧ��
����÷�Ӧ�� �ȷ�Ӧ��
��2��ͼ�б�ʾNO2�ı仯�������� ����O2��ʾ��0~2 s�ڸ÷�Ӧ��ƽ������v= ��
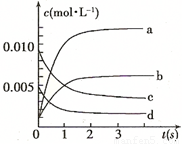
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
a��v(NO2)=2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)=2v��(O2) d���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ��� ��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч����
��1��K=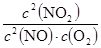 (1��) ���� (1��)
(1��) ���� (1��)
��2��b (1��) 1.5��10-3mol/(L��s�� (2��)
��3��bc (2��) ��4��c (1��)
��������
�����������1������ƽ�ⳣ���Ķ����д��ƽ�ⳣ���ı���ʽ����Ϊ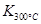 ��
��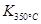 ��˵���¶����ߣ�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
��˵���¶����ߣ�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
��2���ɱ������ݿ������ƽ��ʱNO��ת��Ũ��Ϊ����0.020mol-0.007mol����2L=0.0065mol•L‾1����NO2���ӵ�Ũ��Ϊ0.0065mol•L‾1�����ϵ�����Ϊb��v��O2��=1/2��0.020mol-0.008mol����2L��2s=1.5��10-3mol/(L��s����
��3��a��v(NO2)��v(O2)����ʾ����Ӧ���ʣ�����b����Ӧǰ����������ʵ�����ͬ��������ѹǿ���ֲ��䣬˵����Ӧ�Ѵﵽƽ�⣬��ȷ��c��v�� (NO)=2v��(O2)��ʾ����Ӧ���ʵ����淴Ӧ���ʣ���ȷ��d�����������غ㶨�ɣ�������������䣬����Ϊ2L���ܶ�Ϊ��ֵ��������Ϊƽ����ж����ݣ�����
��4��a����ʱ�����NO2���壬��Ӧ���ʼ�С�����������⣻b����Ϊ����ӦΪ���ȷ�Ӧ������ƽ�����淴Ӧ�����ƶ������������⣻c������O2Ũ�ȣ���Ӧ��������ƽ��������Ӧ�����ƶ�����ȷ��d����Ч����ͬ�ȱ��������������淴Ӧ���ʣ�ƽ�ⲻ�ƶ������������⡣
���㣺���⿼��ƽ�ⳣ������ѧ��Ӧ���ʵļ��㡢��ѧƽ��״̬���жϡ�ͼ��ķ����������Է�Ӧ���ʺͻ�ѧƽ���Ӱ�졣


 ͬ������ϵ�д�
ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ��/s | 0 | 1 | 2 | 3 | 4 |
| n��A��/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| N2+3H2?2NH3 | ||||
| �¶� | 25�� | 200�� | 400�� | 600�� |
| ƽ�ⳣ��K | 5��108 | 650 | 0.507 | 0.01 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
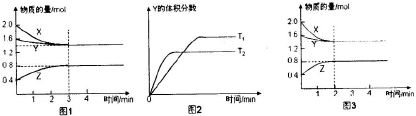
| A����Ӧ���е�ǰ3min�ڣ���X��ʾ�ķ�Ӧ����V��X��=0.1mol/��L?min�� | B��ƽ��ʱ�����ڵ�ѹǿΪ��Ӧǰ��0.8�� | C�����������������䣬�����¶ȣ���Ӧ�Ļ�ѧƽ�ⳣ��K��С | D�����ı䷴Ӧ������ʹ��Ӧ������ͼ3��ʾ����ı������������ѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʱ��/s | 0 | 1 | 2 | 3 | 4 |
| n��A��/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�걱������ͷ��������ѧ�߶����£���ĩ��ѧ�Ծ��������棩 ���ͣ������
| ʱ��/s | 1 | 2 | 3 | 4 | |
| n��A��/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com