
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
【答案】 秒表 S2O![]() +2H+===H2O+S↓+SO2↑ SO2会部分溶于水 测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度,或其他合理答案) 4 T1 <T2 <T3
+2H+===H2O+S↓+SO2↑ SO2会部分溶于水 测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度,或其他合理答案) 4 T1 <T2 <T3
【解析】(1)从实验装置可知,本实验是通过测量在一个时间段内所收集到的气体的体积来测定反应速率,故还缺少的仪器是秒表,故答案为:秒表;
(2)S2O32-在酸性条件下发生硫元素的歧化反应,由+2价歧化为0价和+4价,即产物为S和SO2和H2O,故离子方程式为:S2O32-+2H+═H2O+S↓+SO2↑,故答案为:S2O32-+2H+═H2O+S↓+SO2↑;
(3)SO2易溶于水,导致所测得的SO2的体积偏小,则据此计算出的△n(H+)和△c(H+)以及v(H+)会变小,故答案为:SO2会部分溶于水;
(4)根据反应S2O32-++2H+═H2O+S↓+SO2↑可知,可以通过测定一段时间段内生成的单质硫的质量或实时测定溶液中氢离子浓度来求出H+的物质的量的改变量,从而利用v=![]() =
=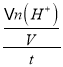 来求算,故答案为:测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度);
来求算,故答案为:测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度);
(5)为了探究反应物浓度对化学反应速率的影响,则除了Na2S2O3溶液的浓度不同外,应保持其他影响因素一致,即应使溶液体积均为16mL,故Vx=4mL;由于在三个实验中Na2S2O3溶液的体积①>②>③,而混合后溶液体积相同,故混合后Na2S2O3浓度①>②>③,可知化学反应速率①>②>③,反应所需时间T的大小T1<T2<T3,故答案为:4;T1<T2<T3。


科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化,均能一步实现的是( )
①SO2 ![]() (NH4)2SO3
(NH4)2SO3 ![]() (NH4)2SO4
(NH4)2SO4
②煤 ![]() 焦炭
焦炭 ![]() (CO+H2)
(CO+H2) ![]() CH3OH
CH3OH
③C4H10 ![]() C2H4
C2H4 ![]()
![]()
④(C6H10 ![]() )n(淀粉)
)n(淀粉) ![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖) ![]()
![]() H5OH.
H5OH.
A.①②③④
B.①③④
C.③④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A 0.2mol在足量O2中完全燃烧,生成二氧化碳22.4L(标准状况),生成水21.6g.回答下列问题:
(1)通过计算确定A的化学式.
(2)写出烃A可能的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.在任何物质分子中都含有化学键
B.HF、HCl、HBr、HI的沸点依次升高
C.D2O分子与H2O分子是所含电子总数不相等的分子
D.CO2、PCl3分子中所有原子都满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途或变化,说法正确的是 ( )
A.碳酸钠是发酵粉的主要成分B.次氯酸钙是漂白粉的有效成分
C.SO2有漂白性可以用来漂白面条等食品D.N2与O2在放电条件下直接化合生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
(1)Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
序号 | 反应 | c(H2O2)/ | V(H2O2) | m(MnO2) | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
a.设计实验2和实验3的目的是研究对化学反应速率的影响;
b.为研究温度对化学反应速率的影响,可以将实验和实验作对比(填序号);
c.将实验1和实验2作对比,t1t2(填“>”、“<”或“=”).
(2)Ⅱ.以KI和FeCl3反应为例(2Fe3++2I﹣2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1molL﹣1KI溶液②0.1molL﹣1 FeCl3溶液③0.1molL﹣1 FeCl2溶液
④0.1molL﹣1盐酸⑤0.1molL﹣1KSCN溶液⑥CCl4
实验步骤:
a.取5mL 0.1molL﹣1 KI溶液,再滴加几滴0.1molL﹣1 FeCl3溶液;
b.充分反应后,将溶液分成三份;
c.取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
d.另取一份,加试剂(填序号),现象,说明此反应存在一定的限度.
(3)Ⅲ.N2O4可分解为NO2 . 在100mL密闭容器中投入0.01mol N2O4 , 利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示: 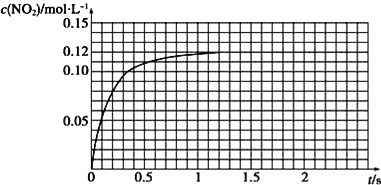
a.反应容器中最后剩余的物质有 , 其中N2O4的物质的量为mol;
b.c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后 . (选填“变大”,“变小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com