
分析 (1)常压下三氧化硫的含量已很高,为节约成本,无需增大压强;
(2)对N2(g)+3H2(g)?2NH3(g);△H<0,温度越高越不利于平衡向正方向移动,但在温度角度反应速率较低,不利于反应的进行;
(3)沸腾炉中出来的混合气中含有很多杂质,能够引起催化剂中毒.
解答 解:(1)常压下三氧化硫的含量已很高,为节约成本,无需增大压强,因增大压强,需要增大设备的抗压能力,且消耗能源,
故答案为:常压下,三氧化硫的含量已达到91%,从降低成本考虑,没有必要再加压;
(2)工业合成氨的反应是可逆的,选择500℃左右的较高温度能使反应逆向进行,不利于化学平衡的正向移动,使用该温度主要是考虑催化剂的催化效率以及反应速率等知识,所以工业合成氨选择反应条件为500℃的主要原因是催化剂催化效率高、反应速率快,故答案为:催化剂催化效率高、反应速率快;
(3)沸腾炉中出来的混合气中含有很多杂质,能够引起催化剂中毒,所以防止催化剂中毒,故答案为:防止催化剂中毒.
点评 本题考查工业生产中外界条件的影响,题目难度不大,注意工业生产在环保、安全的基础上以经济效益为中心进行综合分析解答.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
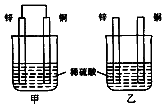
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 两烧杯中溶液的pH均增大 | |
| C. | 甲中电子通过导线由锌片流向铜片,再回到锌片 | |
| D. | 乙中产生气泡的速度比甲快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
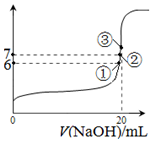 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,颗粒大小相同的锌粒分别与pH值相同的硫酸和盐酸反应 | |
| B. | A+B$\stackrel{500℃}{→}$C;D+E$\stackrel{100℃}{→}$F | |
| C. | 相同温度下,与同浓度盐酸反应的锌粒和铁粉 | |
| D. | G+H→W+Q(Q>0),其他条件相同时分别在200℃和100℃时反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Ca2+ | C. | I- | D. | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
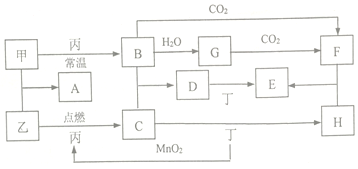
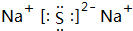 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
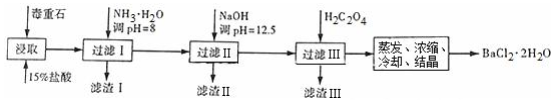
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
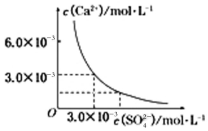
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、Cl+ | B. | Mg2+、Ba2+、Br- | C. | Mg2+、Cl-、Fe2+ | D. | K+、SiO32-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com