
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
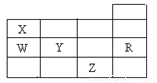
A. 常压下五种元索的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源:2016-2017学年贵州省高二上10月月考化学卷(解析版) 题型:选择题
石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是
A.石墨不如金刚石稳定
B.石墨转变成金刚石是化学变化
C.等质量的金刚石与石墨完全燃烧,放出的能量一样多
D.等质量的金刚石与石墨完全燃烧,石墨放出的能量多
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:实验题
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,
H2SO4溶解Al2O3的离子方程式为:_____________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为: 。
(3)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO 可与Mn2+反应生成MnO2。
可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是__________________、_________________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第二次月考化学试卷(解析版) 题型:选择题
将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L--1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系是( )

查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上学期第一次模拟化学试卷(解析版) 题型:推断题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,F元素的原子最外层电子数是电子层数的二倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体、三种是固体。请回答下列问题:
(1)元素F在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X中所含化学键类型有 。(填数字编号)
①离子键 ②极性键 ③非极性键 ④配位键 ⑤氢键
(4)由A、B两种元素以原子个数比2:1形成的液态化合物Y含有18个电子,其水合物是一种二元弱碱,则Y的电子式为 ;由A、C、F三种元素形成的某化合物能与化合物Y形成一种酸式盐,常温下。1mol/L该酸式盐的pH为1,请写出该酸式盐的化学式 。
(5)化合物Y和A、C形成的18电子分子可相互反应生成两种产物,其中一种产物是空气的主要成分,请写出反应的化学方程式: 。
(6)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
分类是化学学习和研究的常用手段。下列分类结论正确的是( )
① 氨水、氢氧化铝、冰醋酸、氟化氢都是弱电解质
② HClO、浓硫酸、HNO3均具有强氧化性,都是氧化性酸
③ Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
④ HI、CH3COOH、胆矾、氯气都是电解质
⑤ NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物
⑥ 漂粉精、福尔马林、水玻璃、水银都是混合物
⑦ 青铜、硬铝、不锈钢和目前流通的硬币都是合金
⑧ C60、C70、金刚石、石墨都是碳的同素异形体
A.①②③④ B.②⑤⑥⑧ C.②⑦⑧ D.③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
将绿豆大小的方形金属钠投入足量且含酚酞的水中,根据相应现象不能得出的结论是( )
选项 | 实验现象 | 结论 |
A | 方形金属钠变成小球 | 方形钠反应速率快 |
B | 钠浮于水面 | 水的密度大于钠 |
C | 酚酞溶液变成红色 | 有NaOH生成 |
D | 钠球游动,有吱吱声 | 有气体产生 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期10月月考化学试卷(解析版) 题型:选择题
100mL 1mol• 的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
生成CaCO3 | 溶液中 | H2 | 转移的电子 | |
A | 0.1NA | 0.1NA | ||
B | 1.12L | 0.1NA | ||
C | 10g | 0.05NA | ||
D | 10g | 0.1NA |
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高三上第三次月考化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )

A.0-20 s内平均反应速率v(N2O5)=0.1 mol·L-1·s-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com