
科目:高中化学 来源:2012-2013学年江苏省南通市海安县高二上学期期末考试化学试卷(带解析) 题型:填空题
(14分)电化学原理在现代生产生活中有着重要应用。
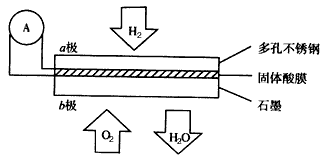
⑴燃料电池是目前发展势头强劲的优秀绿色环保电池。某新型氢氧燃料电池以H2为燃料,O2为氧化剂,H2SO4溶液为电解液),写出该电池的总反应方程式: 。
⑵铝电池性能优越,Al—AgO电池可用作水下动力电源,该电池反应的原理为:
Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。
①该电池反应的负极电极反应式 。
②图中隔膜为阴离子交换膜,溶液中OH-通过向 极移动(选填“正”或“负”)。
用Al—AgO电池作为电源,使用Pt电极电解500mL饱和NaCl溶液,电解一段时间后,恢复至室温,所得溶液pH=13(假设NaCl溶液足量且电解前后体积不变)。
③使用Pt电极电解NaCl溶液的离子方程式 ;
电解过程中放出氢气的体积(标准状况下)为 L。
④若电池的效率为50%,该过程中消耗金属铝的质量为 g。
⑶用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离:Mg(OH)C1 = Mg(OH)+ + C1一。
电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014届江苏省南通市海安县高二上学期期末考试化学试卷(解析版) 题型:填空题
(14分)电化学原理在现代生产生活中有着重要应用。
⑴燃料电池是目前发展势头强劲的优秀绿色环保电池。某新型氢氧燃料电池以H2为燃料,O2为氧化剂,H2SO4溶液为电解液),写出该电池的总反应方程式: 。
⑵铝电池性能优越,Al—AgO电池可用作水下动力电源,该电池反应的原理为:
Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。

①该电池反应的负极电极反应式 。
②图中隔膜为阴离子交换膜,溶液中OH-通过向 极移动(选填“正”或“负”)。
用Al—AgO电池作为电源,使用Pt电极电解500mL饱和NaCl溶液,电解一段时间后,恢复至室温,所得溶液pH=13(假设NaCl溶液足量且电解前后体积不变)。
③使用Pt电极电解NaCl溶液的离子方程式 ;
电解过程中放出氢气的体积(标准状况下)为 L。
④若电池的效率为50%,该过程中消耗金属铝的质量为 g。
⑶用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离:Mg(OH)C1 = Mg(OH)+ + C1一。
电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)航天技术上使用的氢―氧燃料电池具有高能、轻便和不污染环境等优点。氢―氧燃料电池有酸式和碱式两种,它们放电时的电池总反应为: 2H2 + O2 = 2 H2O 。酸式氢―氧燃料电池的电解质是酸,其负极反应可表示为: 2H2 4e- = 4 H+,其正极反应表示为___________ ;碱式氢―氧燃料电池中的电解质是碱,其正极反应表示为: O2 +2H2O+4e-=4OH-,则其负极反应可表示为:
(2)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,正极板上覆盖PbO2,
负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是__________________________
充电时:阴极的电极反应式是
(3)现代工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请
回答下列问题:
①该过程总的离子反应方程式为:
电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使
用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸, 其合理的加入顺序为
_________________(填试剂序号)。
②离子交换膜的作用是 。
 ③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的功能――只允许阳
离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它只
允许阴离子通过,可阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4
溶液,通电电解。阴极的电极反应式为_____________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)航天技术上使用的氢―氧燃料电池具有高能、轻便和不污染环境等优点。氢―氧燃料电池有酸式和碱式两种,它们放电时的电池总反应为: 2H2 + O2 = 2 H2O 。酸式氢―氧燃料电池的电解质是酸,其负极反应可表示为: 2H2 4e- = 4 H+,其正极反应表示为___________ ;碱式氢―氧燃料电池中的电解质是碱,其正极反应表示为: O2 +2H2O+4e-=4OH-,则其负极反应可表示为:
(2)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,正极板上覆盖PbO2,
负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是__________________________
充电时:阴极的电极反应式是
(3)现代工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请
回答下列问题:
①该过程总的离子反应方程式为:
电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使
用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸, 其合理的加入顺序为
_________________(填试剂序号)。
②离子交换膜的作用是 。
 ③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的功能――只允许阳
离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它只
允许阴离子通过,可阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4
溶液,通电电解。阴极的电极反应式为_____________________________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com