
下列化学用语正确的是
A.Mg2+的电子式: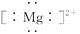
B. 甲烷的比例模型:
C.已知Ni与Co的化合价均只有+2和+3,则在Ni0.25Co0.75(OH)2中Ni的化合价是+2
D.聚氯乙烯的结构简式: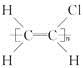
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
用可再生的物质制备乙酸乙酯的绿色合成路线之一如下图所示:
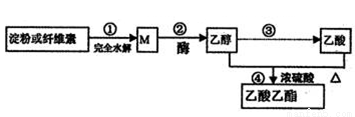
下列说法正确的是
A.常温下,M能与银氨溶液发生反应
B.④的反应类型属于酯化反应,不属于取代反应
C.用饱和碳酸钾溶液能鉴别乙醇、乙酸和乙酸乙酯.
D.淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
有机物M的结构简式为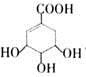 ,下列说法不正确的是
,下列说法不正确的是
A.M的分子式为:C7H10O5 B.M与乙酸互为同系物
C.M可使溴的四氯化碳溶液褪色 D.M在一定条件下可发生取代反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___________;
②硫酸钠和焦炭、石灰石反应的化学方程式为_________(已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
|
|
|
|
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为_____
 __;
__;
(3)联合制碱法对氨碱法的 改进,其优点是______________;
改进,其优点是______________;
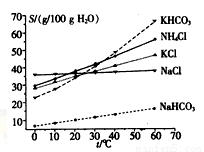
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?_______ ___。
___。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:选择题
下列操作不能达到目的的是
选项 | 目的 | 操作 |
A | 配制100 mL 1.0 mol/L CuSO4溶液 | 将25 g CuSO4·5H2O溶于100 mL蒸馏水中 |
B | 用四氯化碳提取碘水中的碘 | 向碘水中加入适量四氯化碳,振荡、静置,分液 |
C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加含Fe2+溶液至紫色消失 |
D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
a、b、c、d、e五种短周期主族元素,在元素周期表中的相对位置如下表。b与d可以形成两种常见的化合物,下列说法错误的是
|
| a | b |
|
c |
|
| d | e |
A.元素c的氧化物具有两性
B.原子半径的大小顺序为:a>b>c>d>e
C.b元素在地壳中的含量居第一位
D.元素d的非金属性小于e
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:填空题
(13分)化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO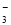 还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12(常温下)。
【 已知:pH=-lgc(H+),常温下,水溶液中c(H+)×c(OH-)=10-14 】
①N2的结构式为________。
②请补充离子方程式,并进行配平:上述反应离子方程式为(配平为1不省略)
( )NO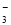 +( )H2 催化剂 ( )N2+( )H2O+( )__________,
+( )H2 催化剂 ( )N2+( )H2O+( )__________,
其平均反应速率v(NO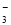 )= mol·L-1·min-1。
)= mol·L-1·min-1。
(2)电化学降解NO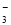 的原理如图所示。
的原理如图所示。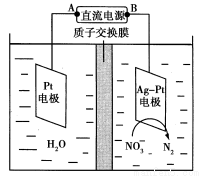
①电源正极为________(填“A”或“B”),
阴极反应式为 。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
勤洗手和经常对环境进行消毒是预防传染病的有效途径。2012年4月,H7N9疫情爆发,可以用某种消毒液进行消毒,预防传染。已知该消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是
A.KMnO4 B.H2O2 C.NaClO D.NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com