
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 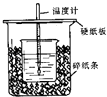
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).
【答案】
(1)环形玻璃搅拌棒
(2)减少实验过程中的热量损失
(3)偏小
(4)不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
(5)偏小
【解析】解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,所以答案是:环形玻璃搅拌器;(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,所以答案是:减少实验过程中的热量损失;(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,所以答案是:偏小;(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25molL﹣1H2SO4溶液跟50mL0.55molL﹣1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所测得中和热数值相等,所以答案是:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,所以答案是:偏小.


科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填空.
(1)如图1是常见仪器的部分结构. 
①写出仪器名称BC
②使用前需检查是否漏水的仪器有 .
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 滴定终点时,锥形瓶中颜色变化为 , 且半分钟内颜色不复原.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图2所示,所用盐酸溶液的体积为mL.
(5)某学生根据3次实验分别记录有关数据如表:
滴定 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备:目前,我国采用“接触法”制硫酸,设备如图所示: 
(1)图中设备A的名称是 , B设备气流a、b温度较高的是(填“a”或“b”).
(2)CuFeS2是黄铁矿的另一部分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2 , 该反应的化学方程式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g);△H=﹣283.0 kJ/mol
O2(g)═CO2(g);△H=﹣283.0 kJ/mol
B.C(s)+ ![]() O2(g)═CO(g);△H=﹣110.5 kJ/mol
O2(g)═CO(g);△H=﹣110.5 kJ/mol
C.H2(g)+ ![]() O2(g)═H2O(g);△H=﹣241.8 kJ/mol
O2(g)═H2O(g);△H=﹣241.8 kJ/mol
D.2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.![]() =1×10﹣13mol?L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣13mol?L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
D.水电离的c(H+)=1×10﹣13mol?L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法,不正确的是( )
A.双键、三键中都含有π键
B.成键原子间原子轨道重叠愈多,共价键愈牢固
C.因每个原子未成对的电子数是一定的,故与其配对的原子个数也一定
D.所有原子轨道在空间中都有自己的方向性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,有可逆反应nA(g)+mB(g)pC(g)处于平衡状态(已知n+m>p,△H>0).升高温度时 ![]() 的比值;加入催化剂,气体的总物质的量;充入C,则A、B的物质的量 . (增大、减小、不变、不确定)
的比值;加入催化剂,气体的总物质的量;充入C,则A、B的物质的量 . (增大、减小、不变、不确定)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列的3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g)△H=﹣24.8kJ/mol
Fe203(s)+ ![]() CO(g)═
CO(g)═ ![]() Fe3O4(s)+C02(g)△H=﹣15.73kJ/mol
Fe3O4(s)+C02(g)△H=﹣15.73kJ/mol
Fe304(s)+CO(g)═3FeO(s)+C02(g)△H=+640.4kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
A.2SO2(g)+O2(g)2SO3(g)△H<0
B.4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H<0
C.H2(g)+I2(g)2HI(g)△H>0
D.2A(g)+B(g)2C(g)△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com