
【题目】【化学—选修2:化学与技术】
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如下所示。

请回答下列问题:
(1)操作Ⅰ为 。
(2)①加入H2O2发生的主要反应的离子方程式为 ;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为 ;
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为 。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
【答案】(1)加酸溶解,过滤
(2)①2Fe2++H2O2+2H+=2Fe3++2H2O ②促进Fe3+水解,沉淀完全
(3)2NiC2O4 = Ni2O3+3CO↑+CO2↑ (4)ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O 1.25a mol
(5)Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
【解析】
试题分析:(1)分析工艺流程图可知,含镍废料(镍、铁、钙、镁合金为主),要使之变成离子,应该加酸溶解金属,再除去不溶物,所以操作Ⅰ为加酸溶解,过滤。
(2)①加双氧水的目的是氧化Fe2+生成Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
②加入碳酸钠溶液的作用是调节pH,促进铁离子水解,沉淀完全;
(3)草酸镍(NiC2O42H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应,Ni由+2价升高到+3价,则C由+3价降低到+2价,因为生成了混合气体,则另一气体为CO2,所以反应生成Ni2O3、CO、CO2,再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),配平方程式为:2NiC2O4 ![]() Ni2O3+3CO↑+CO2↑;
Ni2O3+3CO↑+CO2↑;
(4)ClO-具有氧化性,Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,得到的离子方程式为ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O;根据离子方程式ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O,a mol二价镍全部转化为三价镍,则参加反应的ClO-的物质的量为0.5amol,根据化学反应Cl2+2OH-═ClO-+Cl-+H2O,已知电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,参加反应的Cl2的物质的量为0.5a÷80%=0.625 a mol,进行电解时,阳极反应式为2Cl--2e-═Cl2↑,则n(e-)=0.625mol×2=1.25a mol。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,Ni的化合价由+3价降低到+2价,则正极反应为3NiO(OH)+3e-+3H2O=3Ni(OH)2+3OH-,负极是Al失电子生成NaAlO2,负极电极反应为Al-3e-+4OH-=AlO2-+2H2O,正、负极相加得电池的总反应,则该电池反应的化学方程式是Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;
②再通入CO___________。
(5)该反应的逆反应速率随时间变化的关系如下图:
①从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)__ __。(单选)

A.升温 B.增大CO2浓度
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸。请填写以下空白。

(1)A、B、C、D的化学式分别是___________、___________、___________、___________。
(2)A→B的化学方程式是________________________________________________________。
(3)C→D的离子方程式是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。①A元素最外层电子数是次外层电子数的2倍。②B的阴离子和C的阳离子与氖原子的电子层结构相同。③在通常状况下,B的单质是气体,0.1 mol B的气体与足量的氢气完全反应共有0.4 mol电子转移。④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。请写出:
(1)A元素的最高价氧化物的结构式___________;B元素在周期表中的位置________________。
(2)C单质在B单质中燃烧的生成物中所含化学键类型有_______________________________;C与D 能形成化合物的电子式______________________。
(3)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为_______________________。
(4)元素D与元素E相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是________(填选项序号)。
a.常温下D的单质和E的单质状态不同 b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应 d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修 3 物质结构与性质】
氮族元素(Nitrogen group)是元素周期表VA 族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和Uup共计六种。
(1)氮族元素的外围电子排布式的通式为 ;基态磷原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 。
(2)PH3分子的VSEPR模型为______________,键角NH3 H2O(填“>”、“<”或“=”)。
(3)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子中氮的杂化方式为 。
(4)从化合物NF3和NH3的结构与性质关系比较,回答它们两者如下性质差异原因:
①NF3的沸点为-129℃,而NH3的沸点为-33℃,其原因是 。
②NH3易与Cu2+反应,而NF3却不能,其原因是 。
(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层,磷化硼晶体的晶胞结构与金刚石类似,磷原子作面心立方最密堆积,则硼原子的配位数为________;已知磷化硼的晶胞边长a=" 478" pm,计算晶体中硼原子和磷原子的核间距(dB-P)=__________pm(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. “立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
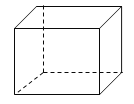
(1)“立方烷”有多种同分异构体,其中一种属于芳香烃的同分异构体的结构简式是 。
(2)立方烷”的三氯代物具有同分异构体的数目是 。
II.有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙烷在空气中燃烧 ②由乙炔制氯乙烯
③甲烷与氯气在光照的条件下反应 ④乙烯使酸性高锰酸钾溶液褪色
⑤乙烯使溴的四氯化碳溶液褪色 ⑥实验室制乙烯
⑦由甲苯制取TNT ⑧溴乙烷和氢氧化钠的乙醇溶液共热
⑨乙苯的制备:![]()
(1)其中属于取代反应的是__________;属于氧化反应的是_______;
(2)写出⑦和⑧的化学方程式:
⑦_______________________ _____________________________
⑧_______________________ _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的气态烃,其中C、H元素质量比为6:1,其标准状况下的密度为1.25gL-1。B、C、D都是含有C、H、O三种元素的有机物,其中D是一种常见厨房调味品中的主要成分。A、B、C、D间有如下转化关系:

请回答下列问题:
(1)D物质中的官能团 。(写名称)
(2)A→B的反应类型 。
(3)B→C的反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N(g)+3H2(g)![]() 2NH3(g),在20℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是()
2NH3(g),在20℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是()

A.点a的正反应速率比b 的小
B.点c处反应达到平衡
C.点d(t2时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,该反应在25℃下反应达到平衡状态,所用的时间比原来的少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:

回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是________________________;
(2)常温下Fe3+比Fe2+要更加稳定的原因是__________________________________;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________ ,写出两个与SO2互为等电子体的分子或离子_______________________。-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
_____________________________________________________________________。
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。
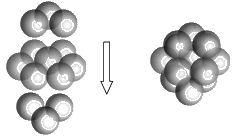
①每个Fe2+周围最近的等距离的S22-离子有____________个。
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为_____________________g·cm-3(列式并计算,阿伏加德罗常数为6.02×1023)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com