
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;
③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是( )
A.②中由水电离出的c(H+)=1×10-12 mol/L
B.将①、③混合,若有pH=7,则消耗溶液的体积:③>①
C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L
D.将四份溶液均稀释10倍后溶液pH:③>④,②<①
D
【解析】 由于CH3COOH为弱电解质,故0.01 mol/L CH3COOH溶液中的c(H+)≠1×10-2mol/L,故由水电离出的c(H+)≠1×10-12mol/L,A项错误;因pH=12的氨水中氨水的浓度远大于0.01 mol/L,0.01 mol/L HCl与pH=12的氨水混合,当pH=7时,消耗溶液的体积:③<①,B项错误;将②、④等体积混合,溶液的总体积增大,c(CH3COO-)+c(CH3COOH)<0.01 mol/L,C项错误。0.01 mol/L HCl稀释10倍后pH=3。CH3COOH是弱酸稀释电离平衡右移,所以0.01 mol/L的CH3COOH稀释10倍后pH<3,D项正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(二)(解析版) 题型:选择题
下列实验操作中,主要不是从安全因素考虑的是 ( )。
A.用NH4Cl、Ca(OH)2制备NH3时,可用如图所示装置吸收尾气
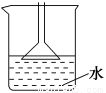
B.制备Fe(OH)2时,吸有NaOH溶液的胶头滴管要插入亚铁盐溶液中再挤出NaOH溶液
C.加热试管中的固体时,试管口应略向下倾斜
D.用氢气还原氧化铜时,先通一会氢气,再加热氧化铜
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第8练金属及其化合物练习卷(解析版) 题型:填空题
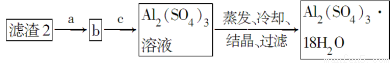
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
沉淀开始时pH | 2.7 | 4.1 | 8.3 |
沉淀完全时pH | 3.7 | 5.4 | 9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第7练电化学原理练习卷(解析版) 题型:选择题
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
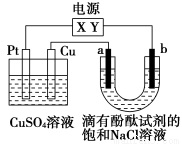
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-=Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第6练水溶液中的离子平衡练习卷(解析版) 题型:填空题
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。
H++A2-。
(1)常温下NaHA溶液的pH________(填序号,下同),原因是_____________。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)??Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第6练水溶液中的离子平衡练习卷(解析版) 题型:选择题
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
A.pH=4的醋酸中:c(H+)=4.0 mol·L-1
B.饱和小苏打溶液中:c(Na+)=c(HCO3—)
C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第5练化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)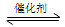 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第4练物质结构与元素周期律练习卷(解析版) 题型:选择题
下列说法中肯定不正确的是( )
①某原子K层上只有1个电子
②某原子M层上的电子数为L层上电子数的4倍
③某离子M层上和L层上的电子数均为K层的4倍
④某离子的核电荷数与最外层电子数相等
A.①③ B.② C.③④ D.④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第1练物质分类化学用语和常用计量练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,18 g H218O含有的原子总数为3NA
B.标准状况下,4.2 g CH2=CH2和CH3CH=CH2的混合气体中所含有的碳原子数为0.3NA
C.将0.1 mol Cl2通入1 L水中,转移的电子数目为0.1NA
D.0.1 mol·L-1Al2(SO4)3溶液中含有的Al3+总数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com