
有机化合物F是合成电子薄膜材料高聚物Z 和增塑剂P的重要原料。
(1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。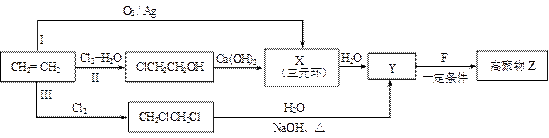
① 3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”) 。
② X的结构简式是 。
③ 1 mol F在O2中充分燃烧,消耗7.5 mol O2,生成8molCO2和3molH2O,1mol F与足量NaHCO3溶液反应生成2 mol CO2。其分子内的氢原子处于3种不同的化学环境。
F分子中含有的含氧官能团的名称是 。
Y+F→Z反应的化学方程式是 。
(2)已知: (R、R'代表烃基或氢原子)。合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个—CH3。
(R、R'代表烃基或氢原子)。合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个—CH3。
① A→B反应的化学方程式是 。
② B→C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氢原子。C的结构简式是 。
③ P的结构简式是 。
④ 符合下列条件的B的同分异构体共有(填数字) 种。
a.在酸性条 件下水解为M和N b.一定条件下M可以转化为N
件下水解为M和N b.一定条件下M可以转化为N
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
(共10分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A |
|
| |||||||||||||||
| B |
|
|
| C | D | E | F |
| |||||||||
| G | H | I | J |
| K | L |
| ||||||||||
|
|
|
|
|
| M |
| N |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)D的氢化物易溶于水的原因
(3)D和E的电负性的大小: > (用元素符号表示)
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 __________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为 。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期三调考试化学试卷(解析版) 题型:填空题
(共10分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
|
|||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
|
|||||||||
|
G |
H |
I |
J |
|
K |
L |
|
||||||||||
|
|
|
|
|
|
M |
|
N |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)D的氢化物易溶于水的原因
(3)D和E的电负性的大小: > (用元素符号表示)
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 __________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为 。

②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | K | L | ||||||||||||
| M | N | ||||||||||||||||
试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)D的氢化物易溶于水的原因
(3)D和E的电负性的大小: > (用元素符号表示)
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
 (5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 __________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为 。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C2+的电子排布式和Ar相同;D的原子序数为24。
(1)判断元素:A 、B 、C 、D 。
(2)以上这四种元素中,属于d区的是______________________(填元素符号)。
(3)C在周期表中的位置为________周期________族。
(4)写出CB2的电子式 。
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有__________(填元素符号
②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是__________(填“极性”或“非极性”)分子。
【解析】考查元素周期表的结构和核外电子的排布规律。1S轨道为半充满的是氢元素,即A是H。电负性最大的就是非金属性最强的,所以B是F。C2+的电子排布式和Ar相同,Ar的原子序数是18,所以C是Ca。原子序数为24的是Cr,则D是Cr。由于Cr最后填入的单质在d轨道上,所以Cr属于d区;CaF2是由离子键形成的离子化合物,其电子式为;因为半充满或全场满是稳定的,所以Cr的最外层电子是1,与之相等的还有K和Cu;CCl4、CS2是非极性分子,根据相似相溶原理可判断DO2Cl2也是非极性分子。
查看答案和解析>>
科目:高中化学 来源:2011-2012年福建漳州芗城中学高二下学期期中考试理科化学试卷(解析版) 题型:填空题
(17分)A、 B、C、D为四种元素,A原子的1S轨道为半充满;在元素周期表中,B的电负性最大;C2+的电子排布式和Ar相同;D的原子序数为24。
(1)判断元素:A 、B 、C 、D 。
(2)以上这四种元素中,属于d区的是______________________(填元素符号)。
(3)C在周期表中的位置为________周期________族。
(4)写出CB2的电子式 。
(5)元素D的化合物(DO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与D同周期的所有元素的基态原子中最外层电子数与D原子相同的元素还有__________(填元素符号
②DO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断DO2Cl2是__________(填“极性”或“非极性”)分子。
【解析】考查元素周期表的结构和核外电子的排布规律。1S轨道为半充满的是氢元素,即A是H。电负性最大的就是非金属性最强的,所以B是F。C2+的电子排布式和Ar相同,Ar的原子序数是18,所以C是Ca。原子序数为24的是Cr,则D是Cr。由于Cr最后填入的单质在d轨道上,所以Cr属于d区;CaF2是由离子键形成的离子化合物,其电子式为 ;因为半充满或全场满是稳定的,所以Cr的最外层电子是1,与之相等的还有K和Cu;CCl4、CS2是非极性分子,根据相似相溶原理可判断DO2Cl2也是非极性分子。
;因为半充满或全场满是稳定的,所以Cr的最外层电子是1,与之相等的还有K和Cu;CCl4、CS2是非极性分子,根据相似相溶原理可判断DO2Cl2也是非极性分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com