
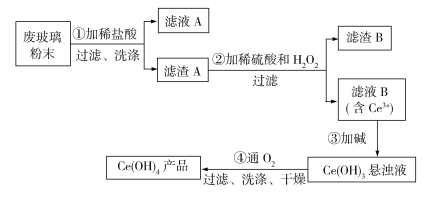
【题目】铈是稀土元素,氢氧化铈[Ce(OH)4]是一种重要的氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
下列说法不正确的是
A.过程①中发生的反应是:Fe2O3+6H+![]() 2Fe3++3H2O
2Fe3++3H2O
B.过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C.过程②中有O2生成
D.过程④中发生的反应属于置换反应
【答案】D
【解析】
该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化FeCl3存在于滤液A中,滤渣A为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣B为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气将Ce从+3价氧化为+4价,得到产品。根据上述分析可知,过程①为Fe2O3与盐酸发生反应,选项A正确;结合过滤操作要点,实验中用到的玻璃仪器有烧杯、漏斗、玻璃棒,选项B正确;稀硫酸、H2O2、CeO2三者反应生成Ce2(SO4)3、O2和H2O,反应的离子方程式为6H++H2O2+2CeO2![]() 2Ce3++O2↑+4H2O,选项C正确;D中发生的反应是4Ce(OH)3+O2+2H2O
2Ce3++O2↑+4H2O,选项C正确;D中发生的反应是4Ce(OH)3+O2+2H2O![]() 4Ce(OH)4,属于化合反应,选项D错误。
4Ce(OH)4,属于化合反应,选项D错误。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.酸性碘化钾溶液中滴加适量双氧水:2I-+2H++H2O2=I2+2H2O
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
C.向苯酚钠溶液中通入少量CO2,溶液变浑浊:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32-
+CO32-
D.铅蓄电池充电时阴极反应式:PbSO42e-+2H2O=PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种原子序数依次递增的前10号元素,X的某种同位素不含中子,Y形成的单质在空气中体积分数最大,三种元素原子的最外层电子数之和为12,其对应的单质及化合物转化关系如图所示。下列说法不正确的是

A.原子半径:X<Z<Y,简单气态氢化物稳定性:Y<Z
B.A、C均为10电子分子,A的沸点低于C的沸点
C.同温同压时,B与D体积比≤1∶1的尾气,可以用NaOH溶液完全处理
D.E和F均属于离子化合物,二者组成中阴、阳离子数目之比均为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。

已知:P204[二(2乙基己基)磷酸酯]常用于萃取锰,P507(2乙基己基膦酸2乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:

加入NaOH溶液调pH=5可除去图中的________(填金属离子符号)杂质;写出除去金属离子的离子方程式________________________(一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)![]() MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)![]() MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________(填“增大”或“减小”);两种萃取剂中___________(填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________mol·L1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________mol·L1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×1016,则沉镍母液中Ni2+的浓度为2.1×1011 mol·L1时,pH=______(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W是一种医药化工合成中间体,其合成路线如下:
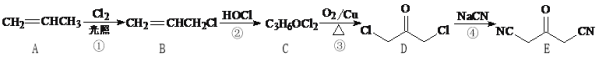
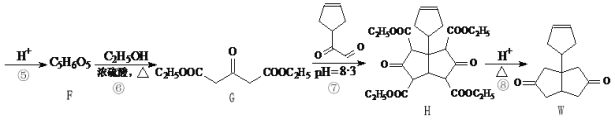
(1)B中官能团的名称是________和_________。
(2)反应④的反应类型是________。
(3)F的结构简式是_________。
(4)芳香化合物X是W的同分异构体,X能够发生银镜反应,核磁共振氢谱有五组峰,峰面积之比为6:4:3:2:1,写出X的一种结构简式:________。
(5)写出以1,2-二氯乙烷和![]() 为原料合成
为原料合成![]() 的合成路线流程图(无机试剂可任选)_________________。合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选)_________________。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和实验现象所得出的结论,正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(NO3)2溶液 | 产生白色沉淀 | 试样已经氧化变质 |
B | 乙醇和浓硫酸混合加热至170℃,将产生气体通入酸性KMnO4溶液 | 紫红色褪去 | 使溶液褪色的是乙烯 |
C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
D | 将炽热的木炭与浓硝酸混合所得气体通入澄清石灰水中 | 澄清石灰水不变浑浊 | 验证碳的氧化产物为CO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究反应![]() (aq)+2I(aq)
(aq)+2I(aq)![]() 2
2![]() (aq)+I2(aq)的反应机理及反应进程中的能量变化,在
(aq)+I2(aq)的反应机理及反应进程中的能量变化,在![]() 和I的混合溶液中加入Fe3+,过程及图像如下:
和I的混合溶液中加入Fe3+,过程及图像如下:
步骤①:2Fe3+(aq)+2I(aq)![]() I2(aq)+2Fe2+(aq)
I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+![]() (aq)
(aq)![]() 2Fe3+(aq)+2
2Fe3+(aq)+2![]() (aq)
(aq)
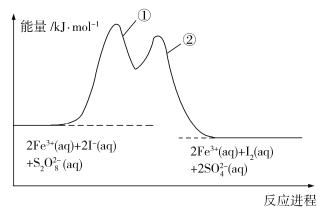
下列有关该反应的说法正确的是______
A.步骤①和②都是吸热反应
B.Fe3+是该反应的中间产物
C.步骤①比②所需活化能大
D.该反应可设计成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素Y在周期表中的位置是___,丙分子的电子式为____。
(2)若甲与Y单质在常温下混合就有明显红棕色气体的现象,则甲的化学式为___。丙在一定条件下转化为甲和乙的反应方程式为___。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为___(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
写出戊与烧碱的浓溶液加热时反应的离子方程式___。
(4)在标准状况下,用装满丙气体的烧瓶做喷泉实验,喷泉结束后水充满烧瓶,假设烧瓶中溶质不能扩散出来,则所得溶液的物质的量浓度为____。(保留两位有效数字)
(5)X与Y两种元素之间可形成一种18e-微粒的分子,此分子是医疗上常用的消毒剂,请写出此分子的结构式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com