
下列反应最终能生成Fe3+的化合物的是( )
①过量Fe与HNO3 ② 铁丝在硫蒸汽中燃烧 ③向FeBr2溶液中通入Cl2
④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
下列有关叙述正确的是( )
A.在一定条件下,反应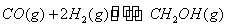 在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持
在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持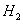 的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变
的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变
B.常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中: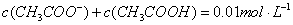
C.pH相同的①CH3COONa;②NaHCO3;③NaAlO3三份溶液中的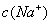 :③>②>①
:③>②>①
D.已知某温度下: ,
,
将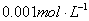 的AgNO3溶液逐滴滴入
的AgNO3溶液逐滴滴入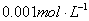 的KCl和
的KCl和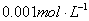 K2CrO4溶液,则先产生
K2CrO4溶液,则先产生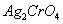 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法中正确的是
A.22.4 L Cl2中含有NA个Cl2分子
B.标准状况下,22.4L CCl4中含有的CCl4分子数为NA
C.1.0 L 浓度为18mol·L-1H2SO4溶液与足量的铜片加热条件下反应,被还原的H2SO4的分子数为9NA
D.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在2008年国际奥林匹克化学竞赛中,某兴趣小组在“探究卤素单质的氧化性”的实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
为此提出问题:Fe3+、Br2谁的氧化性更强?
(1)猜想
①澳大利亚代表团同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②美国代表团同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含________所致。
(2)设计实验并验证
为验证美国代表团同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观
察实验现象,证明了美国代表团同学的观点确实是正确的。
可以选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液。
请你在下表中写出选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(3)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为________________________________________________
(4)依据上述结论,向FeBr2溶液中通入等量Cl2,写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏伽德罗常数,下列说法中不正确的是( )
A.一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1molFeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4•5H2O晶体中含有0.5NA个Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门以实验为基础的科学,化学实验是化学学习的重要内容。
(1)根据你掌握的知识,下列描述正确的是 (填序号)
①将0.2mo1·L-1FeC13溶液滴加沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体;
②将95g蒸馏水倒入盛有5g氯化钠的200ml的烧杯中,搅拌溶解,配制5%的食盐水;
③实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
④使用容量瓶,滴定管、分液漏斗时,首先应检验仪器是否漏水;
⑤向某溶液中加入Ba(NO3)2溶液有白色沉淀产生,加盐酸沉淀不消失,则原溶液中一定含有SO42-。
(2)实验室中需要480ml0.4mo1·L-1CuSO4溶液,应称取硫酸铜晶体(CuSO4·5H2O)的质量是 g;所用仪器除托盘天平(带砝码)、量筒、烧杯、玻璃棒、药匙外,还缺少的玻璃仪器是 ;在观察液面定容时,若俯视刻度线,会使所配制的溶液的浓度 ;(填“偏高、偏低或无影响”下同) 转移溶液前容量瓶内有少量蒸馏水 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氮原子的氮气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
A+B→X+Y+ H2O(为配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,该反应的化学方程式是 .
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是______ (填所在周期和族);Y的化学式是______.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol.
(4)若A、B、X、Y均为化合物.A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则向A中逐滴加入B的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
冰箱制冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3→ClO+O2,ClO+O→Cl+O2下列说法不正确的是 ( )
A.反应后O3转变为O2 B.Cl原子是总反应的催化剂
C.氟氯甲烷是总反应的催化剂 D.Cl原子反复起分解O3的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com