
【题目】下列实验设计能完成或实验结论合理的是( )
A.NH4Cl固体中混有少量的I2 , 可用加热的方法将I2除去
B.少量浓硝酸保存在无色细口瓶中
C.用浓硫酸吸收二氧化硫中混有少量SO3气体
D.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列

表述中正确的是
A. 反应的化学方程式为2X = 3Y + Z
B. t时,正、逆反应都不再继续进行,反应达到化学平衡
C. 若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D. 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应
2SO2(g)+O2(g)![]() 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。

(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为_______,反应放出_____________热量。(用E1、E2或E3表示)
(2)下列叙述能证明该反应已达化学平衡状态的是__________________(填序号)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体原子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)在反应体系中加入催化剂,反应速率增大, E3的变化是: E3 ____________(填“增大”“减小”或“不变”)
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。写出通SO2电极的电极反应式:______________________________________________。

(5) SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生。写出SOCl2在电池中放电时的电极反应式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
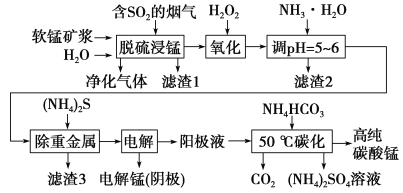
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为_______________________。
(2)“滤渣2”中主要成分的化学式为______________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是______________________。
(4)“电解”时用惰性电极,阳极的电极反应式为_______________________________。
(5)“50 ℃碳化”得到高纯碳酸锰,反应的离子方程式为____________________________。“50 ℃碳化”时加入过量NH4HCO3,可能的原因:使MnSO4充分转化为MnCO3;________________;________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒压下,a mol A和b molB在一个容积可变的容器中发生反应:A(g) +2B(g)![]() 2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
A. 物质A、B的转化率之比为l:2
B. 起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b-![]() )
)
C. 当v正(A)=v逆(B)时,反应一定达到平衡状态
D. 充入惰性气体,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或事实的解释正确的是( )
A.Al2O3作耐火材料是因为氧化铝熔点高
B.光导纤维具有很强的导电能力,应用于制造通信光缆
C.过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水
D.FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. NaHCO3溶液的物质的量浓度为0.8 mol/L
B. b点与c点溶液所含微粒种类相同
C. a点溶液中存在的离子是Na+、AlO2-、OH-、H+
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O === Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA (g) +bB (s) ![]() cC (g) +dD (g),其他条件不变,C的物质的量分数中(C)和温度(T)或压强(P)关系如图,其中正确的是
cC (g) +dD (g),其他条件不变,C的物质的量分数中(C)和温度(T)或压强(P)关系如图,其中正确的是
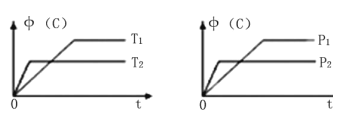
A. 降低温度,平衡正向移动 B. 使用催化剂,中(C)增加
C. 化学方程式系数a+b<c+d D. 其它条件不变,加入B,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:

回答下列问题:
(1) 写出“反应”步骤中生成ClO2的化学方程式:________________________。
(2) “电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别为___________________、___________________。

(3) 亚氯酸钠(NaClO2)在水溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
(4) 为了测定NaClO2·3H2O的纯度,取上述合成产品10.00 g溶于水配成1000 mL溶液,取出20.00 mL溶液于锥形瓶中,再加入足量硫酸酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.2640 mol·L-1Na2S2O3标准溶液滴定,共用去Na2S2O3标准溶液20.00 mL,通过计算确定该产品纯度是否合格?(合格纯度在90%以上)(写出计算过程)__________
提示: 2Na2S2O3+I2===Na2S4O6+2NaI。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com