
下列关于胶体的叙述中不正确的是( )
A.布朗运动是胶体微粒特有的运动方式,只用肉眼就可以把胶体和溶液、浊液区别开来
B.向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀
C.丁达尔效应是胶体的特性
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
科目:高中化学 来源: 题型:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是
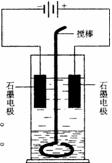 A. 原上层液体是可能是KI的水溶液,原下层液体可能是CCl4
A. 原上层液体是可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解
度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应2AB(g) C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
A.ΔH <0,ΔS>0 B.ΔH <0,ΔS<0
C.ΔH >0,ΔS>0 D.ΔH >0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
①从平衡角度分析采用过量O2的目的是____ ▲ ____;
②列式并计算该条件下反应的平衡常数K=____ ▲ ____。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率____ ▲ ____(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____ ▲ ____。(填字母)
A.SO2和SO3浓度相等 B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___ ▲ ____K(B)(填“>”、“<”或“=”)。
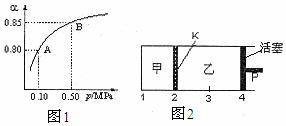
(3)如图2所示,保持温度不变,在一定反 应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲_ ▲ 乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__ _ ▲ ____填:“增大”、“减小”、“不变”、“无法确定”)
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
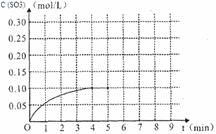
查看答案和解析>>
科目:高中化学 来源: 题型:
向Ba(OH)2溶液中逐滴滴入稀H2SO4,则溶液的导电能力,下列叙述描述正确的是( )
A.开始时,导电能力肯定最强 B.当沉淀为最大值时,导电性最弱
C.先变强,后变弱 D.逐渐变弱
查看答案和解析>>
科目:高中化学 来源: 题型:
在电解质溶液的导电性装置(如右图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗至熄灭,后又逐渐变亮的是( )。
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入NaOH溶液
C.硫酸中逐滴加入Ba(OH)2溶液
D.硫酸铜溶液中逐滴加入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
中华人民共和国国家标准(GB2760-200-)规定葡萄酒中SO2最大使用量为0.25g·L-1.某兴趣小组用题9图I装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
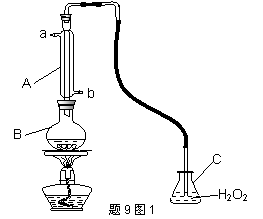

 (1)仪器A的名称是 ,水通入A的进口为 。
(1)仪器A的名称是 ,水通入A的进口为 。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 。
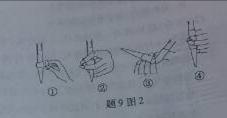
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题9图2中的 ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)
(①=10mL,②=40mL,③<10mL,④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为 g·L-1
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A(分子式为C6H6O)是一种有机化工原料,在空气中易被氧化。A的有关转化反应如下 (部分反应条件略去):
(部分反应条件略去):
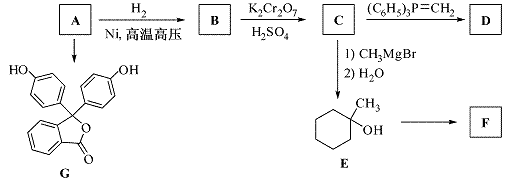
已知:①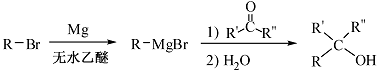
②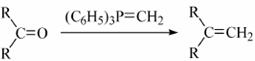 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)
(1)写出A的结构简式:  。
。
(2)G是常用指示剂酚酞。写出G中含氧官能团的名称: 和 。
(3)某化合物是E的同分异构体,且分子中只有两种不同化学环境的氢。写出该化合物的结构简式: (任写一种)。
(4)F和D互为同分异构体。写出反应E→F的化学方程式:
。
(5)根据已有知识并结合相关信息,写出以A和HCHO为原料制备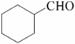 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
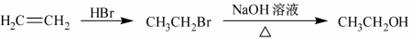
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com