
| V |
| 22.4 |
| V |
| 11.2 |
| V |
| 22.4 |
| V |
| 11.2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高一上学期第二次月考化学试卷(解析版) 题型:选择题
将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为
A. B.
B.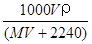
C. D.100VρM(MV+2240)
D.100VρM(MV+2240)
查看答案和解析>>
科目:高中化学 来源:2012届辽宁大连23中高二下学期期末考试化学试卷 题型:选择题
在标准状况下,将VL A气体(摩尔质量为M g/mol)溶于0.1L水中,所得溶液密度为d g/ml,则此溶液的物质的量浓度为( )(单位为mol/L)
A.MV/[22.4(V+0.1)d] B. 1000VdM/(MV+2240)
C. 1000Vd/(MV+2240) D.Vd/(MV+2240)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com