
某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应。小组同学先进行理论预测,提出如下三种可能:
a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生 反应
c.Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式
(2)将预测b补充完整 ,说明预测依据 。
在进行实验验证前,先进行资料收集,得到如下信息:
物质 | 颜色 | 水中溶解性 |
Fe2S3 | 黑色 | 难溶于水 |
FeS | 黑褐色 | 难溶于水 |
进行如下实验:
实验步骤 | 操作 | 现象 | 备注 |
1 | 向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液 | 产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
2 | 继续滴加3滴0.1 mol/L 硫化钠溶液 | 同上 | |
3 | 继续滴加0.1 mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
(3)写出黑色沉淀转变为黄色沉淀的离子方程式
为进一步探究反应实质,该组同学进行了如下实验:
实验步骤 | 操作 | 现象 |
4 | 向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
5 | 继续滴加3滴0.1 mol/L 氯化铁溶液 | 同上 |
6 | 继续滴加0.1 mol/L 氯化铁溶液至过量 | 同上 |
(4)步骤4与步骤1现象不同的原因可能是
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS。请判断他的想法是否合理并说明理由
(6)依据以上实验现象,可得出结论:_________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年广东省肇庆市高二上学期期末化学试卷(解析版) 题型:填空题
(1)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________(写表达式)。
2Ag+(aq)+ S2-(aq),其Ksp=____________(写表达式)。
(2)下列说法错误的是_______:
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
B.多数物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
C.对于Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
D.除去溶液中的Mg2+,用OH- 沉淀Mg2+ 比 用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大;
用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大;
E.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
(3)自然界原生铜的硫化物经氧化、淋滤作用后重生成CuSO4溶液,当这种溶液流向地壳深层遇到闪锌矿(ZnS)时,便会慢慢转化为铜蓝(CuS)[已知 Ksp(ZnS)=2.93×10-25、Ksp(CuS)=6.3×10-36],发生这种变化的原理是 。
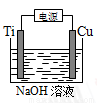
(4)用右图装置,碱性条件下可以电解制备纳米Cu2O。反应为:2Cu+H2O Cu2O+H2↑,如下图所示。该电解池的阳极反应式为 。
Cu2O+H2↑,如下图所示。该电解池的阳极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三1月质检化学试卷(解析版) 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
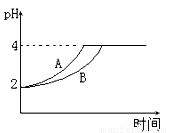
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)。[来
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
(3)某温度下Ksp[ Mg(OH)2] = 2×10 -11,若该温度下某MgSO4溶液里c(Mg 2+) =0.002 mol·L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于 ;该温度 下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分 析该溶液遇酚酞呈红色原因时,
析该溶液遇酚酞呈红色原因时, 甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。
甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。 请你设计一个
请你设计一个 简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
查看答案和解析>>
科目:高中化学 来源:2017届北京市丰台区高三上学期期末化学试卷(解析版) 题型:选择题
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.38 mol/L
B.830℃达平衡时,A的转化率为20%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为0.4
A(g)+B(g)的平衡常数为0.4
查看答案和解析>>
科目:高中化学 来源:2017届北京市丰台区高三上学期期末化学试卷(解析版) 题型:选择题
下列有关性质的比较,不能用元素周期律解释的是
A. 酸性:H2SO4 >HClO B. 金属性:Na>Mg
C. 碱性:KOH>NaOH D. 热稳定性:HC1>HBr
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g )
) M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法不正确的是:
A.实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L·min)
B.实验②中,该反应的平衡常数K=12.5
C.实验②中,达到平衡时,a大于0.16
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数,下列说法正确的是
A.3.2gO2和O3的混合物中含有的氧原子数目为0.2NA
B.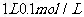 的醋酸溶液中含有氢离子数目为0.1NA
的醋酸溶液中含有氢离子数目为0.1NA
C.标准状况下,2.24LCCl4含碳原子数目为0.1NA
D.将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:选择题
工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列说法不正确的是( )
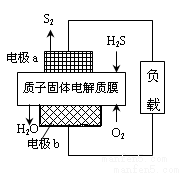
A.电极a为电池的负极
B.电极b上发生的电极反应为O2+4H++4e-=2H2O
C.若电路中通过2mol电子,则电池内部释放632kJ热能
D.若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:填空题
科学家利用太阳能分解 水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以
水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以 甲醇为燃料的燃料电池。请回答下列问题:
甲醇为燃料的燃料电池。请回答下列问题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知,CH3OH(g)的燃烧热__________(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的汽化热为44 kJ/mol,则表示氢气燃烧热的热化学方程式为__________________________。
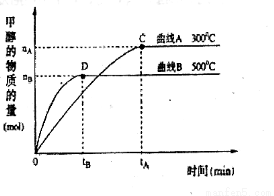
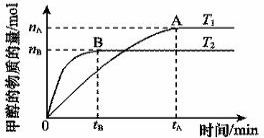
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃)该反应为_________反应(填“放热”或“吸热”);在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平 衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。
衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com