
按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是
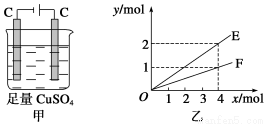
A.F表示反应生成Cu的物质的量
B.E表示反应生成O2的物质的量
C.E表示反应实际消耗H2O的物质的量
D.F表示反应生成H2SO4的物质的量
科目:高中化学 来源:2016届云南省昆明市高三上学期10月摸底调研测试理综化学试卷(解析版) 题型:选择题
反应中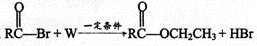 ,W为
,W为
A.CH3CHO B.CH3CH2OH
C.CH3COOH D.H2O
查看答案和解析>>
科目:高中化学 来源:2016届山东师大附中高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.向次氯酸钙溶液通过量CO2:Ca2++2C1O-+H2O+CO2====CaCO3↓+2HClO
B.碘水中通入足量的SO2:I2+SO2+2H2O====2 HI+SO42-+2H+
C.FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+====2Fe3++2H2O
D.酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列溶液中,与100 ml 0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是
A.100 ml 0.5 mol/L MgCl2 溶液 B.200 ml 0.25 mol/L HCl溶液
C.50 ml 1 mol/L NaCl溶液 D.200 ml 0.25 mol/L CaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2016届山东省济宁市高三上学期期中考试化学试卷(解析版) 题型:选择题
8.34g FeSO4•7H2O(分子量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是( )
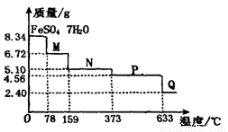
A.温度为78℃时固体物质M的化学式为FeSO4•5H2O
B.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4•H2O FeSO4 +H2O
FeSO4 +H2O
D.温度为l59℃时固体N的化学式为FeSO4•2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中测试化学试卷(解析版) 题型:选择题
V L含有(NH4)2SO4和K2SO4的混合溶液,已知NH4+浓度为a mol·L-1 ;SO42-浓度为bmol·L-1 。则原混合溶液中钾离子的物质的量浓度为
A.(b-2a) mol·L-1 B.(b-2a) /2mol·L-1
C.(2b-a)mol·L-1 D.(2b-a)/2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高二上学期期中测试化学试卷(解析版) 题型:选择题
一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g) 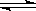 3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
A.4molA+2molB B.3molC+2molD
C.1molB+3molC+1molD D.2molA+1molB+3molC+1molD
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期期中联考化学试卷(解析版) 题型:选择题
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
A.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
B.HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物
查看答案和解析>>
科目:高中化学 来源:2016届江西上高第二中学高三12月月考理科综合化学试卷(解析版) 题型:实验题
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:

实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1) 步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式表示原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式 。
(4)常用Na2S2O3溶液测定废水中Ba2+ 浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010 mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
编号 | 1 | 2 | 3 | 4 |
消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
① Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O; ②I2+2S2O32-
2Cr3++3I2+7H2O; ②I2+2S2O32- 2I-+S4O62-。
2I-+S4O62-。
①判断达到滴定终点的现象是__ _____________
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为 ml
③废水中Ba2+的物质的量浓度__________________。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com