
【题目】已知过氧化铬(CrO5)的结构式如下图所示,过氧化铬不稳定,溶于水生成过氧铬酸;溶于酸生成铬(III)盐(绿色)并放出氧气,反应方程式为:4CrO5+12H+=4Cr3++7O2+6H2O)。下列有关说法正确的是( )
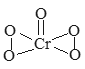
A. CrO5中Cr元素的化合价为+10
B. 过氧化铬中含有极性共价键、非极性共价键和离子键
C. 过氧化铬具有较强的氧化性
D. 上述反应每转移0.2mol电子就能生成2.24LO2
【答案】C
【解析】
A. CrO5中存在过氧键、Cr-O键、Cr=O键;
B.不同非金属元素之间易形成极性键;
C. CrO5能和水反应生成酸,和酸反应生成铬酸盐和氧气;
D.温度和压强未知,无法计算氧气的物质的量。
A. CrO5中存在2个过氧键、1个Cr=O键,所以4个O原子显-1价、1个O原子显-2价,所以Cr元素显+6价,故A错误;
B.不同非金属元素之间易形成极性键,所以CrO5中不存在极性键,故B错误;
C. CrO5能和水反应生成酸,所以为酸性氧化物,和酸反应生成铬酸盐和氧气,Cr元素化合价由+6价变为+3价,所以CrO5具有较强的氧化性,所以C选项是正确的;
D.温度和压强未知,无法计算氧气的物质的量,导致无法计算转移电子的物质的量,故D错误。
所以C选项是正确的。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaClO(aq)![]() HClO(aq)
HClO(aq)![]() Cl2(g)
Cl2(g)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)
D. N2(g)![]() NO(g)
NO(g)![]() HNO3(aq)
HNO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下各组物质在发生相应变化时所克服的微粒间作用力完全相同的是( )
A. 干冰升华和液溴挥发
B. 金刚石熔化和硫磺(S8)熔化
C. 硝酸钾溶于水和H2SO4溶于水
D. KHSO4熔融和HI分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于容积为5L的密闭容器中,发生如下反应:3A(g) +B(g) ![]() 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)求用C来表示的该反应的速率__________________;
(2)求反应前A的物质的量浓度____________________;
(3)反应10s后,求B物质的转化率_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车专项中一项重要课题。我国镍氢电池居世界先进水平,解放军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零)。电池反应通常表示为LaNi5H6+6NiO(OH) ![]() LaNi5+6Ni(OH)2。关于镍氢电池放电时的下列说法中不正确的是( )
LaNi5+6Ni(OH)2。关于镍氢电池放电时的下列说法中不正确的是( )
A. 储氢合金作负极
B. 正极反应式:6NiO(OH)+6H2O+6e-=6Ni(OH)2+6OH-
C. 负极反应式:LaNi5H6+6OH--6e-=LaNi5+6H2O
D. 电子由正极通过外电路流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如图所示.下列说法正确的是
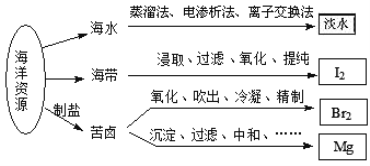
A. 从海水中获取淡水,历史最久的方法是离子交换法
B. 实验室中从海带中获得I2,需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等
C. 用Na2CO3溶液吸收从苦卤中吹出的单质溴时,发生的化学反应可以是3Br2+3Na2CO3═5NaBr+ NaBrO3+3CO2或3Br2+6Na2CO3+3H2O═5NaBr+NaBrO3+6NaHCO3
D. 用贝壳、盐酸等从苦卤中提取镁时,发生反应的类型有化合、分解、置换和复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲和乙两位同学探究乙烯与溴的加成反应。
甲同学设计并进行的实验:
①先用乙醇和浓硫酸制取乙烯:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
②将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应;
③乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量还原性的杂质气体,由此提出必须先除去杂质,再与溴水反应。
请回答下列问题。
(1)甲同学设计的实验___ (填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是_____。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙烯
D.使溴水褪色的物质,就是乙烯
(2)乙同学推测此乙烯中必定含有一种杂质气体是___,它与溴水反应的化学方程式是______。
(3)乙同学为了先除去杂质气体,再进行推测验证,设计了如下图所示的实验装置。

图中各装置盛放的试剂(填序号)是Ⅰ________,Ⅱ________,Ⅲ________。
A.品红溶液 B.氢氧化钠溶液 C.溴水 D.酸性高锰酸钾溶液
(4)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测定反应溶液的酸性,理由是_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C4H4有多种同分异构体,分别具有以下特征, 试写相应同分异构体的结构简式.
(1)A为链状结构, 可以由两分子的乙炔加成而得;A为 ________.
(2)B为平面结构, 与溴水发生1:1加成反应, 加成方式有两种, 但加成产物只有一种.;B为 ________ 。B还能发生加聚反应,写出加聚产物:_______________。
(3)C 为正四面体, 每个C原子分别与另三个C 原子通过单键相连,则C为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
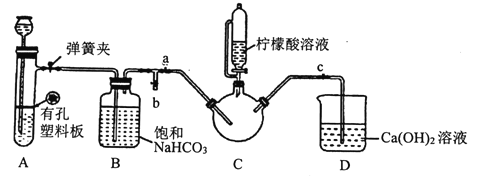
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为____(写化学式)。
(2)实验II中:生成沉淀的离子方程式为________________。
(3)实验III中:
①检查装置A的气密性的方法是_________。
②装置A中所盛放的药品是_______ (填序号)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀盐酸
③确认c中空气排尽的实验现象是______________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_______。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是___(填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com