
| A、0.02mol |
| B、0.03mol |
| C、0.04mol |
| D、0.01mol |


科目:高中化学 来源: 题型:
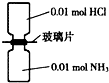 NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )
NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )| A、反应前气体的总体积为0.448L |
| B、生成物中含有0.01NA个分子 |
| C、装置中氢元素的总质量为0.04g |
| D、生成物完全溶于水后所得溶液含有0.01NA个NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有SO42-的溶液:Ca2+、NH4+、HCO3-、Cl- |
| B、c(Fe2+)=0.5 mol/L的溶液:H+、Na+、Cl-、SO42- |
| C、pH=1的溶液:Na+、K+、Cl-、CO32- |
| D、酸性无色透明溶液中:Fe2+、Na+、NO3-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、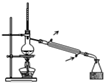 用如图装置可用于分离互不相溶的液体 |
B、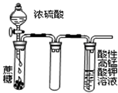 用如图装置酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
C、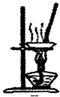 用如图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
D、 用如图确认CO2和NaOH已发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8g NH4+离子中含有的电子数为NA |
| B、常温常压下,1mol甲基(-CH3)所含电子数为10NA |
| C、25℃,1.01×105 Pa下,使V L氯化氢气体溶于水得V L水溶液,所得溶液的物质的量浓度为1/22.4 mol?L-1 |
| D、标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)═2H2O(l)△H=-Q1kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2kJ/mol | ||||
| B、S(g)+O2(g)═SO2(g)△H=-Q1kJ/mol S(s)+O2(g)═SO2(g)△H=-Q2kJ/mol | ||||
| C、C(s)+1/2O2(g)═CO(g)△H=-Q1kJ/mol C(s)+O2(g)═CO2(g)△H=-Q2kJ/mol | ||||
D、H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C3H8O2 |
| B、C2H4O |
| C、C5H10O2 |
| D、C3H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、1:2 | B、1:1 |
| C、2:5 | D、3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com