
【题目】镁-空气电池可用于海滩救生设备和高空雷达仪等。该电池两个电极分别是金属镁和不锈钢丝,其原理如图所示。下列说法正确的是( )
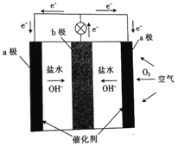
A. a极材料为镁B. a电极的电极反应式 O2+2H2O+4e=4OH
C. 电流方向:b极→a极D. 每消耗1molMg,导线中共流过NA电子
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
)有下列叙述:① 能使酸性KMnO4溶液褪色;② 能使溴的四氯化碳溶液褪色;③ 可溶于水;④ 可溶于苯中;⑤ 能与浓硝酸发生取代反应;⑥ 所有的原子可能共平面。其中正确的是( )
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是

A. 选择合适的试剂,用图甲可分别制取少量CO2、CO和SO2
B. 洗涤沉淀时(见图乙),向漏斗中加入适量水至浸没沉淀并滤干,重复2-3次
C. 用图丙所示装置除去HCl中的少量CO2
D. 用图丁装置从KI和I2的固体混合物中回收I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的化学资源,从海水中可提取多种化工原料。
以下为工业从海水中提取液溴的流程图如下,已知:溴的沸点为59 ℃,微溶于水,有毒性。

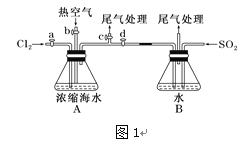
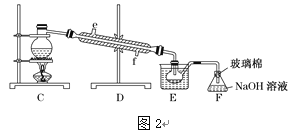
(1)某同学利用“图1”装置进行实验,当进行步骤①时,应关闭活塞___,打开活塞______。
(2)步骤③中反应的离子方程式____________________________。
(3)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是________________________。
(4)步骤⑤用“图2”装置进行蒸馏,C处蒸馏烧瓶中已加入碎瓷片,尚未安装温度计,此外装置C中还有一处,改进后效果会更好,应该如何改进_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是( )
A. 生成的乙酸乙酯中含有18OB. 生成的水分子中含有18O
C. 可能生成44 g乙酸乙酯D. 不可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g) + O2(g)![]() 2SO3(g) + 190 kJ
2SO3(g) + 190 kJ
(1)该反应的平衡常数表达式K =___________,该反应450℃时的平衡常数_________500℃时的平衡常数(填“>”“<”或“=”)。
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2) =____________mol/(L·min)
(3)请写出提高SO2转化率的两种方法__________________、___________________。
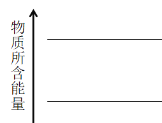
(4)根据反应方程式,请在图中,绘制反应方向箭头,并在合适位置标明物质与热量 ___________。
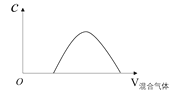
(5)将SO2与SO3的混合气体持续通入一定量的NaOH溶液中,产物中某离子的物质的量浓度与通入气体的体积有如图所示关系,该离子是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com